
Struktura, vlastnosti a použití fosforečnanu vápenatého (Ca3 (PO4) 2)

The fosforečnan vápenatý je anorganická a terciární sůl, jejíž chemický vzorec je Ca3(PO4)dva. Vzorec uvádí, že složení této soli je 3: 2 pro vápník a fosfát. To lze vidět přímo na obrázku níže, kde je zobrazen kation Ca.dva+ a anion PO43-. Za každé tři Cadva+ existují dvě PO43- interakce s nimi.
Na druhou stranu, fosforečnan vápenatý označuje řadu solí, které se liší v závislosti na poměru Ca / P, jakož i na stupni hydratace a pH. Ve skutečnosti existuje mnoho druhů fosforečnanů vápenatých, které existují a lze je syntetizovat. Podle nomenklatury písmene se však fosforečnan vápenatý týká pouze výše uvedeného trikalcia.

Všechny fosforečnany vápenaté, včetně Ca3(PO4)dva, jsou plné bílé s lehce šedivými odstíny. Mohou být zrnité, jemné, krystalické a mají velikost částic kolem mikronů; a dokonce byly připraveny nanočástice těchto fosfátů, s nimiž jsou navrženy biokompatibilní materiály pro kosti.
Tato biokompatibilita je způsobena skutečností, že tyto soli se nacházejí v zubech a zkrátka v kostních tkáních savců. Například hydroxyapatit je krystalický fosforečnan vápenatý, který zase interaguje s amorfní fází stejné soli..
To znamená, že existují amorfní a krystalické fosforečnany vápenaté. Z tohoto důvodu nepřekvapuje rozmanitost a rozmanitost možností při syntéze materiálů na bázi fosforečnanů vápenatých; materiály, v jejichž vlastnostech se každý den více vědců zajímá o obnovu kostí.
Rejstřík článků
- 1 Struktura fosforečnanu vápenatého
- 1.1 Amorfní fosforečnan vápenatý
- 1.2 Zbytek rodiny
- 2 Fyzikální a chemické vlastnosti
- 2.1 Jména
- 2.2 Molekulová hmotnost
- 2.3 Fyzický popis
- 2.4 Příchuť
- 2.5 Teplota tání
- 2.6 Rozpustnost
- 2.7 Hustota
- 2.8 Index lomu
- 2.9 Standardní entalpie tvorby
- 2.10 Skladovací teplota
- 2,11 pH
- 3 Školení
- 3.1 Dusičnan vápenatý a hydrogenfosforečnan amonný
- 3.2 Hydroxid vápenatý a kyselina fosforečná
- 4 použití
- 4.1 V kostní tkáni
- 4.2 Biokeramické cementy
- 4.3 Lékaři
- 4.4 Ostatní
- 5 Reference
Struktura fosforečnanu vápenatého
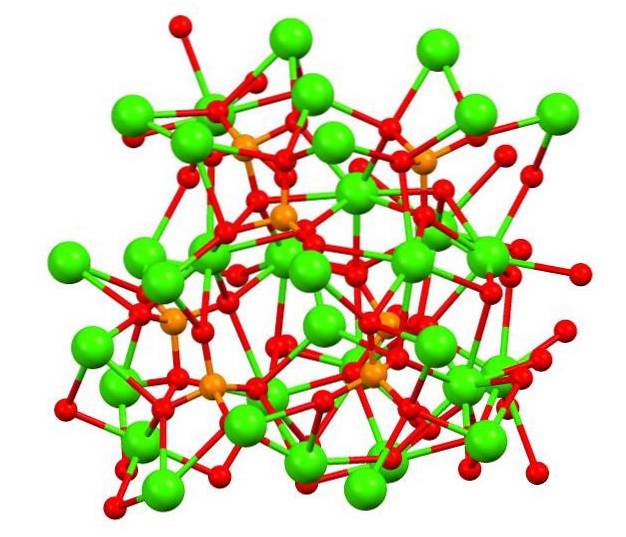
Horní obrázek ukazuje strukturu tribasického kalikofosfátu v podivném minerálu whitlockit, který může obsahovat hořčík a železo jako nečistoty..
I když se to na první pohled může zdát složité, je nutné objasnit, že model předpokládá kovalentní interakce mezi atomy kyslíku fosfátů a kovovými centry vápníku..
Pro názornost je to platné, ale interakce jsou elektrostatické; tj. kationty Cadva+ jsou přitahovány k anionům PO43- (ACdva+- O-PO33-). S ohledem na tuto skutečnost je zřejmé, proč je na obrázku vápník (zelené koule) obklopen záporně nabitými atomy kyslíku (červené koule).
Protože je jich tolik, nezanechává symetrické uspořádání nebo vzor viditelný. Ca.3(PO4)dva přijímá při nízkých teplotách (T.<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)dva (β-TCP).
Při vysokých teplotách se naproti tomu transformuje na polymorf α-Ca3(PO4)dva (α-TCP), jehož jednotková buňka odpovídá monoklinickému krystalovému systému. Při ještě vyšších teplotách může také vznikat polymorf α'-Ca.3(PO4)dva, který má hexagonální krystalickou strukturu.
Amorfní fosforečnan vápenatý
Krystalové struktury byly zmíněny pro fosforečnan vápenatý, který lze očekávat od soli. Je však schopen vykazovat neuspořádané a asymetrické struktury spojené spíše s typem „skla fosforečnanu vápenatého“ než s krystaly v užším smyslu jeho definice..
Pokud k tomu dojde, říká se, že fosforečnan vápenatý má amorfní strukturu (ACP, amorfní fosforečnan vápenatý). Několik autorů poukazuje na tento typ struktury jako na zodpovědnou za biologické vlastnosti Ca3(PO4)dva v kostních tkáních, je možná jeho oprava a biomimetizace.
Objasněním jeho struktury nukleární magnetickou rezonancí (NMR) byla zjištěna přítomnost OH iontů- a HPO4dva- v AKT. Tyto ionty vznikají hydrolýzou jednoho z fosfátů:
PO43- + HdvaNEBO <=> HPO4dva- + Ach-
Výsledkem je, že skutečná struktura ACP se stává složitější, jejíž složení iontů je reprezentováno vzorcem: Ca9(PO4)6-x(HPO4)X(ACH)X. Písmeno „x“ označuje stupeň hydratace, protože pokud x = 1, vzorec by vypadal takto: Ca9(PO4)5(HPO4) (ACH).
Různé struktury, které ACP může mít, závisí na molárních poměrech Ca / P; tj. relativních množství vápníku a fosfátu, která mění celé výsledné složení.
Zbytek rodiny
Fosforečnany vápenaté jsou ve skutečnosti rodinou anorganických sloučenin, které zase mohou interagovat s organickou matricí.
Ostatní fosfáty se získávají "jednoduše" změnou aniontů, které doprovázejí vápník (PO43-, HPO4dva-, HdvaPO4-, Ach-), stejně jako druh nečistot v pevné látce. Přirozeně nebo uměle tedy může vznikat až jedenáct nebo více fosforečnanů vápenatých, každý se svou vlastní strukturou a vlastnostmi..
Níže budou uvedeny některé fosfáty a jejich příslušné chemické struktury a vzorce:
-Dihydrát hydrogenfosforečnanu vápenatého, CaHPO4∙ 2HdvaO: monoklinický.
-Monohydrát dihydrogenfosforečnanu vápenatého, Ca (HdvaPO4)dva∙ HdvaNebo: triclinic.
-Bezvodý fosforečnan dikyseliny, Ca (HdvaPO4)dva: triclinic.
-Octakalciumfosforečnan (OCP), Ca8Hdva(PO4)6: triclinic. Je předchůdcem syntézy hydroxyapatitu.
-Hydroxyapatit, Ca5(PO4)3OH: šestihranný.
Fyzikální a chemické vlastnosti
Jména
-Fosforečnan vápenatý
-Fosforečnan trivápenatý
-Difosforečnan trivápenatý
Molekulární váha
310,74 g / mol.
Fyzický popis
Je to bílá pevná látka bez zápachu.
Chuť
Bez chuti.
Bod tání
1670 ° K (1391 ° C).
Rozpustnost
-Prakticky nerozpustný ve vodě.
-Nerozpustný v ethanolu.
-Rozpustný ve zředěné kyselině chlorovodíkové a kyselině dusičné.
Hustota
3,14 g / cm3.
Index lomu
1629
Standardní entalpie formace
4 126 kcal / mol.
Skladovací teplota
2-8 ° C.
pH
6-8 ve vodné suspenzi 50 g / l fosforečnanu vápenatého.
Výcvik
Dusičnan vápenatý a hydrogenfosforečnan amonný
Existuje mnoho způsobů výroby nebo tvorby fosforečnanu vápenatého. Jedna z nich se skládá ze směsi dvou solí, Ca (NO3)dva∙ 4HdvaO a (NH4)dvaHPO4, dříve rozpuštěné v absolutním alkoholu a vodě. Jedna sůl poskytuje vápník a druhá fosfát.
Z této směsi se vysráží ACP, který se poté 2 hodiny zahřívá v sušárně při 800 ° C. Výsledkem tohoto postupu je získání β-Ca3(PO4)dva. Pečlivým řízením teploty, míchání a doby kontaktu může dojít k tvorbě nanokrystalů.
K vytvoření polymorfu α-Ca3(PO4)dva je nutné fosfát zahřát na 1000 ° C Toto zahřívání se provádí v přítomnosti jiných kovových iontů, které dostatečně stabilizují tento polymorf, aby mohl být použit při pokojové teplotě; to znamená, že zůstává ve stabilním meta stavu.
Hydroxid vápenatý a kyselina fosforečná
Fosforečnan vápenatý lze také připravit smícháním roztoků hydroxidu vápenatého a kyseliny fosforečné za vzniku acidobazické neutralizace. Po půl dni zrání v matečných louzích a jejich náležité filtraci, promytí, sušení a prosetí se získá granulovaný amorfní fosfátový prášek, ACP..
Tento produkt ACP reaguje při vysokých teplotách a transformuje se podle následujících chemických rovnic:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(StrdvaNEBO7)0,5(PO4)5(OH) + HdvaO (při T = 446,60 ° C)
2Ca9(StrdvaNEBO7)0,5(PO4)5(OH) => 3Ca3(PO4)dva + 0,5 HdvaO (při T = 748,56 ° C)
Tímto způsobem se získá β-Ca3(PO4)dva, jeho nejběžnější a stabilní polymorf.
Aplikace
V kostní tkáni
Ca.3(PO4)dva je to hlavní anorganická složka kostního popela. Je to součást transplantace kostní náhrady, což je vysvětleno její chemickou podobností s minerály přítomnými v kosti.
Biomateriály fosforečnanu vápenatého se používají k nápravě kostních defektů a k povlakování kovových titanových protéz. Usazuje se na nich fosforečnan vápenatý, který je izoluje od okolního prostředí a zpomaluje proces titanové koroze..
Fosforečnany vápenaté, včetně Ca3(PO4)dva, Používají se k výrobě keramických materiálů. Tyto materiály jsou biokompatibilní a v současné době se používají k obnovení úbytku alveolární kosti v důsledku periodontálního onemocnění, endodontických infekcí a dalších stavů..
Měly by se však používat pouze k urychlení periapikální opravy kostí v oblastech, kde nedochází k chronické bakteriální infekci..
Fosforečnan vápenatý lze použít k opravě kostních defektů, pokud nelze použít autogenní kostní štěp. Může být použit samostatně nebo v kombinaci s biologicky odbouratelným a vstřebatelným polymerem, jako je kyselina polyglykolová.
Biokeramické cementy
Fosforečnan vápenatý (CPC) je další biokeramika používaná k opravě kostní tkáně. Vyrábí se smícháním prášku různých typů fosforečnanů vápenatých s vodou za vzniku pasty. Pastu lze injikovat nebo přizpůsobit kostnímu defektu nebo dutině.
Cementy jsou formovány, postupně resorbovány a nahrazovány nově vytvořenou kostí.
Lékaři
-Ca.3(PO4)dva Je to zásaditá sůl, proto se používá jako antacida k neutralizaci přebytečného pálení žáhy a zvýšení pH. V zubních pastách poskytuje zdroj vápníku a fosfátu pro usnadnění procesu remineralizace hemostázy zubů a kostí.
-Používá se také jako doplněk výživy, ačkoli nejlevnějším způsobem, jak dodávat vápník, je použití jeho uhličitanu a citrátu..
-Fosforečnan vápenatý lze použít při léčbě tetanie, latentní hypokalcemie a udržovací terapii. Kromě toho je užitečný při doplňování vápníku během těhotenství a kojení..
-Používá se při léčbě kontaminace radioaktivními izotopy radium (Ra-226) a stroncium (Sr-90). Fosforečnan vápenatý blokuje absorpci radioaktivních izotopů v zažívacím traktu, čímž omezuje poškození jimi způsobené.
Ostatní
-Fosforečnan vápenatý se používá jako krmivo pro ptáky. Kromě toho se používá v zubních pastách ke kontrole zubního kamene..
-Používá se jako prostředek proti spékání, například k zabránění zhutnění kuchyňské soli.
-Funguje jako bělidlo na mouku. Mezitím ve sádle zabraňuje nežádoucímu zbarvení a zlepšuje stav smažení..
Reference
- Tung M.S. (1998) Fosforečnany vápenaté: struktura, složení, rozpustnost a stabilita. In: Amjad Z. (eds) Fosforečnany vápenaté v biologických a průmyslových systémech. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu a Honglian Dai. (2018). „Synthesis, Characterization of Nano-β-Tricalcium Phosphate and the Inhibition on Hepatocellular Carcinoma Cells,“ Journal of Nanomaterials, sv. 2018, ID článku 7083416, 7 stran, 2018.
- Hřebeny, Christ a Rey, Christian. (2010). Amorfní fosforečnany vápenaté: syntéza, vlastnosti a použití v biomateriálech. Acta Biomaterialia, sv. 6 (č. 9). str. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Fosforečnan trivápenatý. Obnoveno z: en.wikipedia.org
- Abida a kol. (2017). Prášek fosforečnanu vápenatého: Příprava, charakterizace a zhutňovací schopnosti. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Fosforečnan vápenatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Fosforečnan vápenatý. Science Direct. Obnoveno z: sciencedirect.com



Zatím žádné komentáře