
Struktura fosfidu hlinitého (AIP), vlastnosti, použití, rizika
The fosfid hlinitý Je to anorganická sloučenina tvořená atomem hliníku (Al) a atomem fosforu (P). Jeho chemický vzorec je AlP. Je to pevná tmavě šedá nebo, je-li velmi čistá, žlutá. Je to extrémně toxická sloučenina pro živé bytosti.
Fosfid hlinitý reaguje s vlhkostí za vzniku fosfinu nebo fosfanu PH3, což je jedovatý plyn. Z tohoto důvodu nesmí AlP přijít do styku s vodou. Silně reaguje s kyselinami a zásaditými roztoky.

V minulosti se používal k eliminaci škůdců, jako je hmyz a hlodavci, na místech, kde byla skladována obilná zrna a jiné zemědělské produkty. Kvůli vysokému nebezpečí však byl ve většině zemí světa zakázán..
V současné době se jeho užitečnost v oblasti elektroniky teoreticky zkoumá pomocí počítačů, které vypočítávají možnost získání polovodičových AlP nanotrubiček, tedy extrémně malých trubiček, které mohou přenášet elektřinu pouze za určitých podmínek..
Fosfid hlinitý je velmi nebezpečná směs, musí se s ním zacházet s bezpečnostními pomůckami, jako jsou rukavice, brýle, respirátory a ochranný oděv..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Chemické vlastnosti
- 3.7 Další vlastnosti
- 4 Získání
- 5 použití
- 5.1 Při likvidaci škůdců (ukončené používání)
- 5.2 V jiných aplikacích
- 6 Teoretický výzkum nanotrubiček AlP
- 6.1 AlP nanotrubice s bórem
- 6.2 AlP nanotrubice se změněnou strukturou
- 7 Rizika
- 8 Reference
Struktura
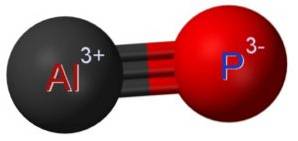
Fosfid hlinitý AlP je tvořen spojením atomu hliníku Al a atomu fosforu P. Vazba mezi oběma je kovalentní a trojná, proto je velmi silná.
Hliník v AlP má oxidační stav +3 a fosfor má valenci -3.
Nomenklatura
- Fosfid hlinitý
Vlastnosti
Fyzický stav
Tmavě šedá nebo tmavě žlutá nebo zelená krystalická pevná látka. Krychlové krystaly.
Molekulární váha
57,9553 g / mol
Bod tání
2550 ° C
Hustota
2,40 g / cm3 při 25 ° C
Rozpustnost
Rozkládá se ve vodě.
Chemické vlastnosti
Reaguje s vlhkostí za vzniku fosfinu nebo fosfanu PH3 což je hořlavá a jedovatá sloučenina. Fosfin nebo fosfan se spontánně vznítí při kontaktu se vzduchem, s výjimkou přítomnosti přebytečné vody.
Reakce fosfidu hlinitého s vodou je následující:
Fosfid hlinitý + voda → hydroxid hlinitý + fosfin
AlP + 3 HdvaO → Al (OH)3 + PH3↑
Obchodní prezentace mají uhličitan hlinitý Aldva(CO.)3)3 aby se zabránilo samovznícení fosfinu, ke kterému dochází při kontaktu AlP s vlhkostí ve vzduchu.
AlP je za sucha stabilní. Prudce reaguje s kyselinami a alkalickými roztoky.
Fosfid hlinitý AlP se při teplotách vyšších než 1 000 ° C neroztaví, nevyzařuje ani se tepelně nerozkládá. I při této teplotě je jeho tlak par velmi nízký, to znamená, že se při této teplotě neodpařuje..
Při zahřátí na rozklad vydává toxické oxidy fosforu. Při styku s kovy může uvolňovat hořlavé vodíkové plyny Hdva.
Další vlastnosti
Je-li čistý, vykazuje nažloutlé zbarvení, po smíchání se zbytky z reakční směsi má barvu od šedé po černou..
Jeho nízká těkavost vylučuje jakýkoli zápach, takže vůně česneku, kterou někdy vydává, je způsobena fosfinem PH3 který se tvoří za přítomnosti vlhkosti.
Získávání
Fosfid hlinitý lze získat zahřátím směsi kovového práškového hliníku (Al) a červeného fosforu (P).
Vzhledem k afinitě fosforu (P) ke kyslíku (Odva) a hliníku (Al) kyslíkem a dusíkem (Ndva), musí být reakce provedena v atmosféře bez těchto plynů, například v atmosféře vodíku (Hdva) nebo zemní plyn.
Reakce je zahájena rychlým zahříváním zóny směsi, dokud reakce nezačne, což je exotermické (během reakce se vytváří teplo). Od tohoto okamžiku reakce probíhá rychle.
Hliník + fosfor → fosfid hlinitý
4 Al + P4 → 4 AlP
Aplikace
Při likvidaci škůdců (ukončené používání)
Fosfid hlinitý se v minulosti používal jako insekticid a jako prostředek proti hlodavcům. Přestože byl pro svou toxicitu zakázán, v některých částech světa se stále používá..
Používá se k fumigaci v uzavřených prostorách, kde jsou zpracované nebo nezpracované zemědělské potravinářské výrobky (například obiloviny), krmivo pro zvířata a nepotravinářské výrobky.
Cílem je ovládnout hmyz a hlodavce, kteří napadají uložené předměty, ať už jedlé, nebo ne..
Umožňuje potírat hlodavce a hmyz v jiných než domácích, zemědělských nebo nezemědělských oblastech, postřikovat venku nebo v jejich norách a hnízdech, aby se zabránilo přenosu určitých chorob.


Jeho forma použití spočívá v vystavení AlP vzduchu nebo vlhkosti, protože se uvolňuje fosfin nebo fosfan PH.3 který poškozuje mnoho orgánů škůdce, které mají být odstraněny.

V jiných aplikacích
Fosfid hlinitý AlP se používá jako zdroj fosfinu nebo fosfanu PH3 a používá se ve výzkumu polovodičů.
Teoretický výzkum nanotrubiček AlP
Byly provedeny teoretické studie o tvorbě nanotrubiček AlP fosfidu AlP. Nanotrubice jsou velmi malé a velmi tenké válce, které lze vidět pouze elektronovým mikroskopem..
AlP nanotrubice s bórem
Teoretické studie prováděné pomocí výpočtových výpočtů ukazují, že nečistoty, které by mohly být přidány do nanotrubiček AlP, by mohly změnit teoretické vlastnosti těchto.
Například se odhaduje, že přidání atomů boru (B) do nanotrubiček AlP by je mohlo změnit na polovodičový typ-p. Polovodič je materiál, který se chová jako vodič elektřiny nebo jako izolátor v závislosti na elektrickém poli, kterému je vystaven.
A polovodičový typ-p To je, když se do materiálu přidají nečistoty, v tomto případě je AlP výchozí materiál a atomy boru by byly nečistoty. Polovodiče jsou užitečné pro aplikace elektroniky.
AlP nanotrubice se změněnou strukturou
Někteří vědci provedli výpočty k určení účinku změny struktury krystalové mřížky nanotrubiček AlP z hexagonální na oktaedrickou..
Zjistili, že manipulace s mřížkovou strukturou by mohla být použita k doladění vodivosti a reaktivity nanotrubiček AlP a jejich navržení tak, aby bylo užitečné pro aplikace elektroniky a optiky..
Rizika
Kontakt s fosfidem hlinitým může dráždit pokožku, oči a sliznice. Při požití nebo vdechnutí je toxický. Může být absorbován kůží s toxickými účinky.
Pokud AlP přijde do styku s vodou, reaguje a tvoří fosfin nebo fosfan PH3 který je extrémně hořlavý, protože se vznítí při kontaktu se vzduchem. Proto může explodovat. Fosfin navíc způsobuje smrt lidí a zvířat.
Protože fosfid hlinitý je levný pesticid, je jeho použití běžnou příčinou otravy u lidí a přináší vysokou úmrtnost..

Reaguje s vlhkostí sliznic a s kyselinou chlorovodíkovou HCl v žaludku a vytváří velmi toxický plynný fosfát PH3. Proto se při vdechování a požití vytváří v těle fosfin, který má fatální účinky..
Jeho požití způsobí během několika hodin krvácení z gastrointestinálního traktu, kardiovaskulární kolaps, neuropsychiatrické poruchy, respirační a renální selhání..
AlP je velmi toxický pro všechna suchozemská a vodní zvířata.
Reference
- NÁS. Národní lékařská knihovna. (2019). Fosfid hlinitý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. a kol. (2007). Hliník. Ostatní sloučeniny hliníku. In Handbook on the Toxicology of Metals (Third Edition). Obnoveno ze sciencedirect.com.
- Gupta, R.C. a Crissman, J.W. (2013). Posouzení bezpečnosti včetně aktuálních a vznikajících problémů v toxikologické patologii. Lidské riziko. V příručce Haschek and Rousseaux's Handbook of Toxicology Pathology (třetí vydání). Obnoveno ze sciencedirect.com.
- White, W.E. a Bushey, A.H. (1944). Fosfid hlinitý - příprava a složení. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Obnoveno z pubs.acs.org.
- Mirzaei, Maryam a Mirzaei, Mahmoud. (2011). Teoretická studie nanotrubiček fosfidu hlinitého dopovaného borem. Computational and Theoretical Chemistry 963 (2011) 294-297. Obnoveno ze sciencedirect.com.
- Takahashi, L. a Takahashi, K. (2018). Ladění elektronické struktury nanotrubice z fosfidu hlinitého prostřednictvím konfigurace mřížkové geometrie. ACS Appl. Nano Mater. 2018, 1, 501-504. Obnoveno z pubs.acs.org.
- Gupta, P.K. (2016). Toxické účinky pesticidů (agrochemikálií). Fosfid hlinitý. In Základy toxikologie. Obnoveno ze sciencedirect.com.

Zatím žádné komentáře