
Vlastnosti, typy, techniky a histologie krevního nátěru

The Krevní nátěr Jedná se o nátěr periferní krve, který se používá k analýze složek přítomných v krevním oběhu. Pozorování krevního nátěru poskytuje hematologická data, která jsou velmi užitečná pro diagnostiku a sledování mnoha patologických stavů..
Krevní nátěr umožňuje kvantifikovat počet různých typů bílých krvinek (vzorec leukocytů) a umožňuje analýzu morfologie a tvaru erytrocytů, leukocytů a krevních destiček.

Může detekovat abnormality v počtu buněk, jako jsou: leukocytóza nebo leukopenie, lymfocytóza nebo lymfopenie, neutrofilie nebo neutropenie, trombocytóza nebo trombocytopenie a eosinofilie. Rovněž lze pozorovat abnormality tvaru a velikosti buněk..
Dále je možné detekovat různé typy anémií, leukémií a bakteriálních nebo krevních parazitárních infekcí..
K tomu existují různé typy nátěrů, které se provádějí v závislosti na účelu studie. Existují tenké šmouhy a husté šmouhy. Tyto nátěry se liší technikou provedení a účelem studie..
Pacienti s jemnými kapkami se používají jako doplněk k dokončení hematologie. To poskytuje údaje o vzorci leukocytů, kromě analýzy tvaru a morfologie tří buněčných řad, které tvoří krev: červené řady, bílé řady a destičky. I když také slouží jako doplněk ke studiu tlustého krevního filmu.
Tlustý krevní film se používá k diagnostice onemocnění způsobených hemoparazity, jako je malárie nebo malárie, toxoplazmóza, leishmanióza, Chagasova choroba, babezióza a mikrofilariáza.
Rejstřík článků
- 1 Vlastnosti krevního nátěru
- 2 Druhy krevního nátěru
- 3 Techniky pro odběr vzorků krve
- 4 Techniky pro přípravu krevního nátěru
- 4.1 - Klouzavé skvrny
- 4.2 - Poleva na krycích sklíčcích
- 4.3 - S automatizovaným vybavením
- 5 Technika silného rozmazání
- 6 Barvení šmouh
- 6.1 Giemsova skvrna
- 6.2 Wrightova skvrna
- 7 typů vadných šmouh
- 7.1 Šmouhy s oblastmi různé tloušťky (tenké a silné proložené)
- 7.2 Šmouhy s velmi krátkými šmouhami
- 7.3 Potřete hrablou oblastí ke konci nátěru
- 7.4 Šmouhy s tvorbou vakuol nebo jasné zaoblené nebo eliptické oblasti
- 7.5 Velmi silné nebo velmi tenké šmouhy
- 8 Histologie
- 8.1 - Erytrocyty nebo červené krvinky
- 8.2 - Bílé krvinky nebo leukocyty
- 8.3 - Destičky
- 9 Patologické prvky
- 9.1 Krevní paraziti
- 9.2 Bakterie
- 9.3 Nezralé buňky
- 10 Reference
Vlastnosti krevního nátěru
Dobrý krevní nátěr musí splňovat určité vlastnosti. Mezi nimi můžeme zmínit:
-Aby byl vzorek reprezentativní, musí vzorek splňovat minimální požadavky na kvalitu.
-Odběr vzorků musí být proveden dobře.
-Včasné provedení nátěru.
-Pokud se provádí s venózní krví, použijte antikoagulant, který nedeformuje buňky, a promíchejte tubu před odebráním nátěru..
-Pokud je to provedeno kapilární krví, první kapku zlikvidujte.
-Nátěr musí být homogenní. Tím je zajištěno, že jsou buňky rovnoměrně rozloženy a že lze provést dobrou analýzu krevních buněk, pokud jde o tvar a počet..
-Boky nátěru by měly být od začátku do konce hladké.
-Nátěr by měl respektovat okraj 1 až 2 mm po stranách sklíčka.
-Vrstva nátěru by se měla postupně zmenšovat v tloušťce od začátku do konce (nátěr na tenké kapky metodou sklíčka).
-Musí být řádně označeny, aby nedošlo k záměně vzorků.
-Vhodně zafixujte a obarvíte, abyste jasně sledovali krevní prvky.
-Před nasazením přípravku pod mikroskop nechejte nátěr velmi dobře zaschnout. Ponoření oleje na vlhký nátěr způsobí tvorbu micel, které zabraňují vidění buněk..
Druhy krevního nátěru
Nátěry z periferní krve lze rozdělit na tenké nátěry a silné nátěry. Ty s tenkou vrstvou se používají ke studiu vzorce leukocytů a morfologickému pozorování krevních buněk. Můžete také vidět extracelulární bakterie, jako jsou borrelia a intracelulární hemoparazity, jako je plasmodium..
V jemném blobu lze identifikovat druh parazita, proto se jedná o specifičtější techniku než tlustý blob, ale tlustý blob je citlivější, protože se jedná o koncentrační techniku používanou pro vyčerpávající hledání extracelulárních hemoparazitů..
Existují dva typy jemných kapek: ty, které se provádějí na diapozitivech, a ty, které se provádějí na krycích sklíčcích. Husté šmouhy se provádějí na diapozitivech.
Techniky pro odběr vzorků krve
Krevní nátěry lze připravit kapilární punkcí nebo žilním vzorkem odebraným s antikoagulanty. Pokud se provádí z krve antikoagulanty, lze nátěr připravit až 2 hodiny po odebrání vzorku..
Je třeba dbát opatrnosti při užívání antikoagulancií, které nedeformují krevní buňky. Nejlepší možností je EDTA. Naopak je třeba se vyvarovat použití antikoagulancií, jako je citrát trisodný..
Pokud je vzorek odebrán kapilární punkcí, měl by být nátěr okamžitě rozšířen, než dojde ke srážení krve.
První kapka by měla být zlikvidována, aby další kapka mohla spontánně uniknout, aby nedošlo k naředění vzorku tkáňovou tekutinou. Jedná se o nejvíce doporučenou techniku pro pozorování morfologie buněk, protože krev neobsahuje žádné přísady.
Pro pozorování hemoparazitů Solari et al. Ve svém výzkumu dospěli k závěru, že obě techniky (venepunkční a kapilární) jsou stejně účinné..
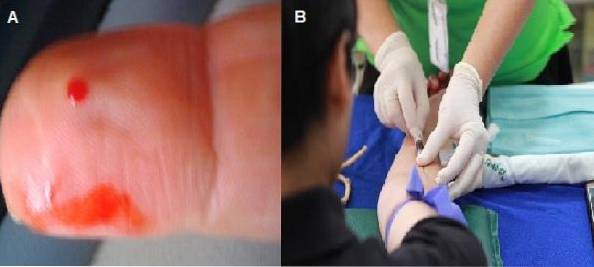
Techniky pro přípravu krevního nátěru
Krevní nátěr lze provést ručně na podložním sklíčku mikroskopu nebo na krycím sklíčku nebo sklíčku. Je to také možné prostřednictvím automatizovaného zařízení.
-Nanášejte na snímky
Je to technika preferovaná většinou laboratoří kvůli její snadné manipulaci.
Pomocí Pasteurovy pipety vložte do středu jednoho konce čistého mikroskopického sklíčka ne příliš silnou nebo velmi jemnou kapku krve..
Nátěr se vyrábí pomocí dalšího sklíčka s broušeným koncem. Podložní sklíčko je umístěno kolmo na opačný konec kapky..
Nakloní se do úhlu mezi 30 - 45 ° a klouže směrem k kapce; Při dotyku se lineárně roztahuje přes okraj podložního sklíčka a konstantním a definovaným pohybem se list vrací; před dosažením konce se snímek zvedne.
Tímto způsobem se po povrchu přijímacího sklíčka rozloží homogenní vrstva..
Roztěr se nechá zaschnout. Poté se zafixuje a obarví preferovanou barvou. Před pozorováním pod mikroskopem nechejte dobře zaschnout. Kapka oleje se umístí na obličej, který představuje skvrnu, a je pozorována pod světelným mikroskopem.
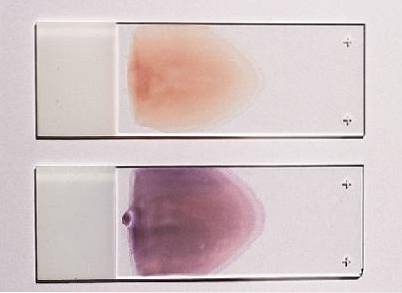
Části nátěru na diapozitivech
U tohoto typu nátěru lze rozlišit tři definované oblasti: hlavu, tělo a ocas. Hlava odpovídá oblasti, kde nátěr začíná, je to nejsilnější oblast a není dobré ji pozorovat.
Tělo je centrální nebo střední část nátěru, je to nejlepší oblast pod mikroskopem, protože tam jsou buňky rovnoměrně rozloženy a jejich morfologie je zachována.
Ocas odpovídá konečné části nátěru; zde distribuce již není jednotná a morfologie erytrocytů má tendenci se ztrácet.
Kontrola kvality v diapozitivu
V této technice hraje zásadní roli:
-Čištění a odmaštění podložního sklíčka mikroskopu: zajišťuje dobrý skluz vzorku.
-Velikost kapky: s velmi velkými kapkami se získá silnější a delší šmouha, s velmi malou kapkou bude rozpětí kratší a extrémně jemné.
-Rychlost použitá v prodloužení: čím nižší bude rychlost nátěru tenčí, tím vyšší bude tloušťka.
-Úhel provedení: čím menší úhel, tím jemnější nátěr, tím vyšší úhel, tím silnější.
-Nátěr na krycím sklíčku
Není široce používán, protože je obtížné manipulovat s křehkými krycími sklíčky, nabízí však velké výhody, protože je dosaženo lepší distribuce buněk v nátěru..
Do středu krycího sklíčka se umístí ne příliš silná nebo velmi jemná kapka. Okamžitě na ni umístíme další krycí sklíčko tak, aby špičky obou krycích sklíček trčely a tvořily hvězdu.
Kapka se spontánně rozšíří po povrchu obou krycích sklíček. Na konci prodloužení se každá lamela rychle sklouzne na opačnou stranu (jedna doprava a druhá vlevo).
Tato technika poskytuje dva nátěry místo jednoho.
Jsou umístěny k sušení roztaženou stranou nahoru. Po zaschnutí je fixován a obarven zvolenou technikou. Nechte to uschnout. Kapka imerzního oleje se umístí na sklíčko, skvrna se umístí skvrnou dolů a pozoruje se pod mikroskopem..
Kontrola kvality v technice krycího sklíčka
Pro získání dobrého nátěru pro tuto techniku je důležité:
-Čištění krycích sklíček (pomáhá dobrému posunutí vzorku).
-Velikost kapky (ovlivňuje tloušťku nátěru).
-Rychlost, s jakou jsou krycí sklíčka oddělena (ovlivňuje homogenitu nátěru).
-S automatizovaným vybavením
Lze je provést pomocí kteréhokoli z těchto zařízení: Spinner a Autoslide.
Spinner spočívá v umístění sklíčka s kapkou krve na speciální centrifugační desku. Vzorek je centrifugován při vysokých rychlostech; tímto způsobem se vytvoří homogenní a jemný nátěr vzorku. Nevýhoda možnosti hemolýzy vzorku.
Autoslide je nástroj, který mechanicky provádí pohyby pro provedení nátěru na diapozitivech. Stěr můžete také opravit a obarvit. Může být dokonce přizpůsoben některým automatickým hematologickým čítačům.
Technika silného nátěru
Při hledání hemoparazitů se doporučuje provést dva nátěry: jeden s jemným kapátkem a druhý se silným kapátkem..
Proveďte kapilární punkci, vyčistěte první kapku. Umístěte jemnou kapku na sklíčko a rozmazejte, jak bylo vysvětleno výše. U tlustého korálku položte velký korálek na další sklíčko a roztáhněte jej na čtverec 1,55 mm. Nechte dva šmouhy zaschnout.
Rozmazání skvrn
Pro ty, kteří mají jemné kapky, lze mimo jiné použít skvrny Giemsa nebo Wright. Pro husté skvrny se doporučuje Giemsa nebo May-Grunwald Giemsa.
Giemsova skvrna
Roztěr se fixuje po dobu 3 minut metanolem, odsaje se a nechá se znovu zaschnout. Nátěr se poté po dobu 10-15 minut pokryje Giemsovým barvivem. Promyje se destilovanou vodou a nechá se uschnout. Pro pozorování pod mikroskopem je umístěna kapka ponorného oleje.
Wrightova skvrna
Roztěr je po dobu 5 minut pokryt Wrightovým skvrnou. Zlikvidujte a umístěte pufrovací roztok na pH 6,8 po dobu 6 minut. Vyfoukněte přípravek, aby se zhomogenizoval. Omyjte destilovanou vodou a nechte zaschnout. Pozorujte pod mikroskopem.
Vadné typy stěrů
Vyskytuje se u účastníků techniky jemného pádu se snímky.
Nanášejte na plochy různých tloušťek (tenké a silné proložené)
Je to proto, že provedený pohyb nebyl během šíření konstantní, takže se zastavil a restartoval.
Velmi krátký nátěr
Mají 2 příčiny: jedna je způsobena skutečností, že pozemní skluzavka byla zvednuta před dosažením druhého konce skluzavky. V tomto případě je extrémně silný a krátký.
Na druhou stranu, pokud je nátěr krátký, ale tenký, je to proto, že velikost kapky byla velmi malá..
Ke konci nátěru promažte hrablou plochu
Má to několik příčin: jednou je, že broušená hrana je vadná, že tlak vyvíjený na přijímací šoupátko se zvyšuje v době rozmetání nebo že je broušená hrana šoupátka opotřebovaná.
Nátěr s tvorbou vakuol nebo jasné zaoblené nebo eliptické oblasti
Jsou způsobeny použitím mastných šmouh (špatně umyté a odmaštěné).
Velmi silné nebo velmi tenké šmouhy
Kapky, které jsou příliš velké, způsobí velmi silné šmouhy od začátku do konce a velmi malé kapky vytvoří velmi jemné šmouhy.
Histologie
Krevní buňky lze vidět v krevním nátěru. Mezi ně patří:
-Erytrocyty nebo červené krvinky
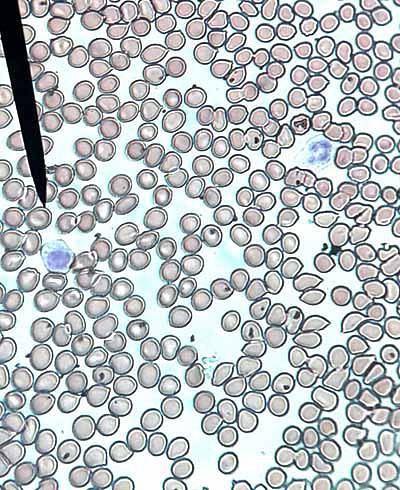
Počet erytrocytů nebo červených krvinek je přibližně 5 x 106 mm3 u člověka a 4,5 x 106 u žen. Červené krvinky mají tvar bikonkávních disků s centrální fyziologickou bledostí. Může být viděn samostatně (normální) nebo stohování v rouleaux (abnormální).
Šmouhy také ukazují poikilocytózu (červené krvinky různých tvarů), anizocytózu (červené krvinky různých velikostí), anizopoikilocytózu (různé tvary a velikosti), anizochromii (různé barvy), erytroblasty (nezralé červené krvinky), mikrocytózu (menší červené krvinky)) a makrocyty (větší erytrocyty).
Když vykazují nedostatek množství hemoglobinu a zvyšuje se centrální bledost, říká se, že existuje hypochromie. Když je pozorována normální červená řada, bude označena jako normocytová a normochromní..
-Bílé krvinky nebo leukocyty
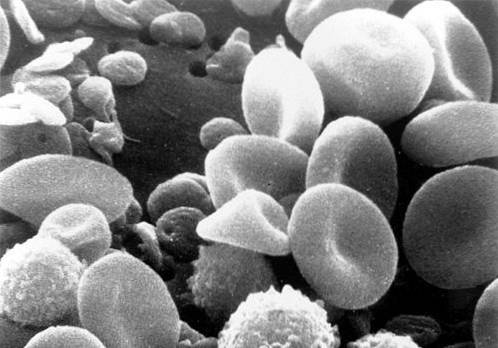
Normální množství se pohybuje od 5 000 do 10 000 mm3. Mění se při infekčních procesech, při alergiích a při leukémii. V krevním nátěru lze rozlišit několik typů, které jsou vysvětleny níže.
Segmentované neutrofily
Představují 55-65% z celkového počtu leukocytů. Měří mezi 10-15 μm. Mají segmentované nebo laločnaté jádro, které přijímá různé morfologie, proto se mu říká polymorfonukleární.
Ve své cytoplazmě mají bohaté neutrofilní granule a některé azurofily. Zvýšení bakteriálních infekcí (neutrofilie), snížení virových infekcí (neutropenie).
Lze pozorovat morfologické abnormality, jako je pleokaryocytóza (hypersegmentovaná jádra), oblouk (nezralé buňky) nebo makropolity (oválného tvaru a velké)..
Další úpravy:
-Toxické granulace
-Pseudo Pelgerovy neutrofily (jádra jsou neobnažená nebo dvojlaločná).
-Döhleova těla: tmavomodré cytoplazmatické inkluze.
-Zvýšená cytoplazmatická bazofilie.
-Intracytoplazmatické vakuoly.
-Buněčná pyknóza (ztráta mezijaderných mostů).
Segmentované eozinofily
Představují 1-3% z celkového počtu bílých krvinek. Měří 9-10 μm. Vyznačují se přítomností hojných acidofilních cytoplazmatických granulí a několika azurofilů. Jeho jádro má dvě lobulace. Jejich počet se zvyšuje u alergií a onemocnění parazitického původu.
Segmentované bazofily
Jsou extrémně vzácné a představují 0–1% leukocytů. Měří 10-12 μm. Jádro má obvykle nepravidelné okraje a může být dvojlaločné, ale není pozorováno kvůli velkému počtu bazofilních hrubých granulací v jeho cytoplazmě. Velmi zřídka lze pozorovat bazofilii.
Lymfocyty
Jsou to malé buňky s bazofilní cytoplazmou, s dobře definovaným, kulatým jádrem, s kondenzovaným chromatinem. Jádro zahrnuje téměř celou buňku. Představují 26-40% krevních leukocytů. Zvyšují se u virových infekcí (lymfocytóza). Lze pozorovat reaktivní lymfocyty.
Monocyty
Buňky větší než lymfocyty, s větší cytoplazmou a volnějšími oválnými jádry chromatinu. Měří 9-12 μm. Cytoplazma je bohatá a při standardních barvicích technikách obvykle vypadá světle šedavě modrá. Mezi změnami lze pozorovat naočkované monocyty a monocytózu..
-Trombocyty
Měří mezi 1,5 - 3 μm. Jeho tvar je kulatý nebo oválný. Normální hodnota se pohybuje od 150 000 do 350 000 krevních destiček / mm3. U některých virových infekcí se mohou snížit. Nemají jádro a jsou zbarveny do fialova. V této sérii lze pozorovat abnormality, jako jsou makro nebo mikro destičky, trombocytóza nebo trombocytopenie a fragmenty krevních destiček..
Patologické prvky
Hematické parazity
V krevních nátěrech lze pozorovat hemoparazity, jako je původce malárie nebo malárie (paraziti rodu Plasmodium). Z tohoto důvodu je důležité, aby byl nátěr analyzován ručně, protože automatizované zařízení toto zjištění přehlíží..
Bakterie
U patologických stavů, jako je recidivující horečka nebo borelióza, lze pozorovat jeho původce. V tomto případě to odpovídá spirochetám Borrelia recurrenti Přesto Borrelia burgdorferi v krevním nátěru.
Nezralé buňky
Závažné případy jsou pozorovány mimo jiné u leukémií, leukemoidních reakcí a leukoerytroblastických reakcí. U bakteriálních infekcí mohou být mírné odchylky vlevo (přítomnost podvodníků). Erytroblasty lze také pozorovat u některých anémií.
Reference
- Krev a hematopoetická tkáň. Dostupné na: sld.cu
- Gomez A, Casas M. 2014. Angel. Klinická interpretace laboratoře. 8. vydání. Panamerican Medical Editorial.
- Solari Soto L, Soto Tarazona A, Mendoza Requena D, Llanos Accounts A. Srovnání parazitních hustot v hustém poklesu venózní krve versus akupresura v diagnostice malárie vivax. Rev Med Hered 2002; 13 (4): 140-143. K dispozici na: scielo.org.
- Terry Leonard Nelson, Mendoza Hernández Carlos. Důležitost studie nátěru periferní krve u starších osob. Medisur 2017; 15 (3): 362-382. Dostupné na: scielo.sld
- Grinspan S. Studie nátěru periferní krve. Pokračující lékařské vzdělávání. Dostupné na: bvs.hn/RMH
Zatím žádné komentáře