
Charakteristiky a příklady Londonových sil
The Londýnské síly, Londýnské rozptylové síly nebo indukované interakce dipól-dipól jsou nejslabším typem mezimolekulárních interakcí. Jeho název je dán příspěvky fyzika Fritze Londýna a jeho studií v oblasti kvantové fyziky.
Londýnské síly vysvětlují, jak molekuly interagují, jejichž struktury a atomy mu znemožňují vytvoření trvalého dipólu; to znamená, že to zásadně platí pro nepolární molekuly nebo izolované atomy vzácných plynů. Na rozdíl od ostatních Van der Waalsových sil vyžaduje tato extrémně krátké vzdálenosti.

Dobrou fyzickou analogii londýnských sil lze najít v provozu systému zapínání na suchý zip (obrázek výše). Stisknutím jedné strany látky vyšívané háčky a druhé vláken se vytvoří přitažlivá síla, která je úměrná ploše látek.
Jakmile jsou obě tváře zapečetěny, je třeba vyvinout sílu, která působí proti jejich interakcím (prováděným našimi prsty), aby se oddělily. Totéž platí pro molekuly: čím jsou objemnější nebo plošší, tím větší jsou jejich intermolekulární interakce na velmi krátké vzdálenosti..
Není však vždy možné přiblížit se k těmto molekulám v dostatečně blízké vzdálenosti, aby byly patrné jejich interakce..
V takovém případě vyžadují velmi nízké teploty nebo velmi vysoké tlaky; jako takový je případ plynů. Podobně mohou být tyto typy interakcí přítomny v kapalných látkách (jako je n-hexan) a pevných látkách (jako je jod)..
Rejstřík článků
- 1 Funkce
- 1.1 Homogenní rozložení zatížení
- 1.2 Polarizovatelnost
- 1.3 Je nepřímo úměrný vzdálenosti
- 1.4 Je přímo úměrný molekulové hmotnosti
- 2 Příklady londýnských sil
- 2.1 V přírodě
- 2.2 Alkany
- 2.3 Halogeny a plyny
- 3 Odkazy
Vlastnosti
Jaké vlastnosti musí mít molekula, aby mohla interagovat pomocí londýnských sil? Odpověď je, že by to mohl udělat kdokoli, ale když existuje trvalý dipólový moment, interakce dipól-dipól převládají více než ty rozptylující, což jen velmi málo přispívá k fyzikální povaze látek..
Ve strukturách, kde neexistují vysoce elektronegativní atomy nebo jejichž distribuce elektrostatického náboje je homogenní, neexistuje extrém nebo oblast, kterou lze považovat za bohatou (δ-) nebo špatnou (δ +) v elektronech.
V těchto případech musí zasahovat jiné typy sil, jinak by tyto sloučeniny mohly existovat pouze v plynné fázi, bez ohledu na tlakové nebo teplotní podmínky, které na nich působí..
Homogenní rozložení zatížení
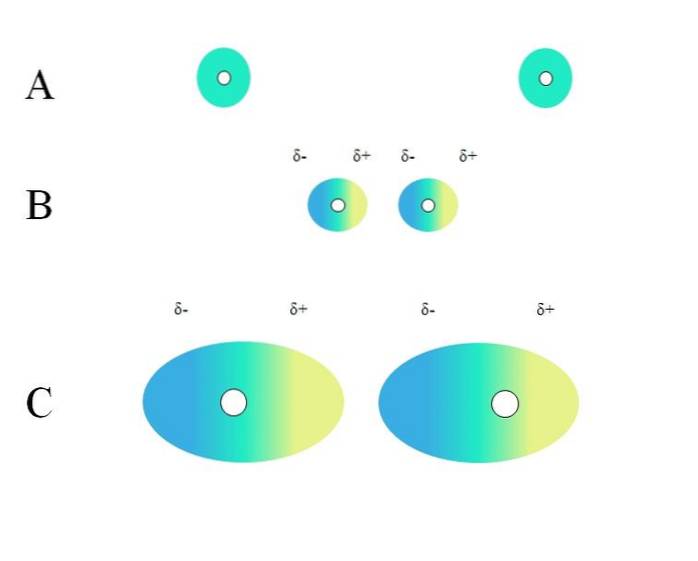
Dva izolované atomy, jako je neon nebo argon, mají homogenní distribuci náboje. To je vidět na A, horní obrázek. Bílé kruhy ve středu představují jádra pro atomy nebo molekulární kostru pro molekuly. Toto rozložení náboje lze považovat za zelený elektronový mrak.
Proč ušlechtilé plyny vyhovují této homogenitě? Protože mají svůj elektronický obal úplně plný, měly by jejich elektrony teoreticky cítit atraktivní náboj jádra rovnoměrně na všech orbitálech..
Na druhou stranu, pro jiné plyny, jako je atomový kyslík (O), je jeho obal neúplný (což je pozorováno v jeho elektronické konfiguraci) a nutí jej, aby vytvořil diatomickou molekulu Odva vyrovnat tento nedostatek.
Zelené kruhy v A mohou být také molekuly, malé nebo velké. Jeho elektronový mrak obíhá kolem všech atomů, které ho tvoří, zejména těch nejvíce elektronegativních. Kolem těchto atomů bude mrak koncentrovaný a bude negativnější, zatímco jiné atomy budou mít elektronický nedostatek.
Tento mrak však není statický, ale dynamický, takže v určitém okamžiku se vytvoří krátké oblasti δ- a δ + a fenomén zvaný Polarizace.
Polarizovatelnost
V A zelený mrak označuje homogenní distribuci záporného náboje. Pozitivní přitažlivá síla vyvíjená jádrem však může na elektronech oscilovat. To způsobí deformaci mraku, a tím vytvoří oblasti δ-, modře a δ +, žlutě..
Tento náhlý dipólový moment v atomu nebo molekule může narušit sousední elektronový mrak; jinými slovy, indukuje náhlý dipól na souseda (B, horní obrázek).
Je to proto, že oblast δ ruší sousední oblak, její elektrony pociťují elektrostatický odpor a jsou orientovány na opačném pólu, přičemž se objevuje δ+.
Všimněte si, jak se kladné póly srovnávají se zápornými póly, stejně jako molekuly s permanentními dipólovými momenty. Čím objemnější bude elektronový mrak, tím obtížnější bude jeho jádro udržovat jej v prostoru homogenní; a také, čím větší je jeho deformace, jak je vidět na C..
Proto je méně pravděpodobné, že atomy a malé molekuly budou polarizovány jakoukoli částicí v jejich prostředí. Příklad této situace ilustruje malá molekula vodíku Hdva.
Aby mohla kondenzovat nebo ještě více krystalizovat, potřebuje přemrštěné tlaky, aby donutila své molekuly fyzicky interagovat.
Je to nepřímo úměrné vzdálenosti
Ačkoli se tvoří okamžité dipóly, které indukují ostatní kolem sebe, nestačí k tomu, aby držely atomy nebo molekuly pohromadě..
V B je vzdálenost d který odděluje dva mraky a jejich dvě jádra. Aby oba dipóly mohly zůstat po určitou dobu, tato vzdálenost d musí to být velmi malé.
Tato podmínka, základní charakteristika londýnských sil (pamatujte na uzávěr na suchý zip), musí být splněna, aby měla znatelný vliv na fyzikální vlastnosti hmoty..
Jednou d je malé, jádro nalevo v B začne přitahovat modrou δ- oblast sousedního atomu nebo molekuly. To dále deformuje mrak, jak je vidět na C (jádro již není ve středu, ale vpravo). Pak přijde bod, kdy se oba mraky dotknou a „odrazí“, ale dostatečně pomalu, aby je na chvíli udržely pohromadě..
Proto jsou londýnské síly nepřímo úměrné vzdálenosti d. Ve skutečnosti je faktor roven d7, takže mírná změna vzdálenosti mezi dvěma atomy nebo molekulami oslabí nebo posílí londýnský rozptyl.
Je přímo úměrná molekulové hmotnosti
Jak zvětšit velikost mraků tak, aby snadněji polarizovaly? Přidání elektronů, a za tím účelem musí mít jádro více protonů a neutronů, čímž se zvýší atomová hmotnost; nebo přidáním atomů k páteři molekuly, což by zase zvýšilo její molekulovou hmotnost
Tímto způsobem by bylo méně pravděpodobné, že jádra nebo molekulární kostra udrží elektronový mrak po celou dobu uniformní. Čím větší jsou zelené kruhy uvažované v A, B a C, tím více budou polarizovatelné a tím větší budou také jejich interakce londýnských sil..
Tento účinek je jasně pozorován mezi B a C a mohl by být ještě větší, pokud by kruhy měly větší průměr. Tato úvaha je klíčem k vysvětlení fyzikálních vlastností mnoha sloučenin na základě jejich molekulových hmot..
Příklady londýnských sil

V přírodě
V každodenním životě existuje nespočet příkladů rozptylových sil Londýna, aniž by se pustil do mikroskopického světa..
Jeden z nejběžnějších a nejpřekvapivějších příkladů se nachází v nohách plazů známých jako gekoni (horní obrázek) a v mnoha hmyzích (také u Spidermana).
Na nohou mají polštářky, ze kterých vyčnívají tisíce malých vláken. Na obrázku můžete vidět gekona pózujícího na svahu skály. K dosažení tohoto cíle využívá mezimolekulární síly mezi horninou a vlákny jejích nohou..
Každé z těchto vláken slabě interaguje s povrchem, na který malý plaz leze, ale protože jich jsou tisíce, vyvíjí sílu úměrnou ploše svých nohou, dostatečně silnou, aby zůstaly připevněny a mohly stoupat. Gekoni jsou také schopni vylézt na hladké a dokonalé povrchy, jako je sklo..
Alkany
Alkany jsou nasycené uhlovodíky, které také interagují londýnskými silami. Jejich molekulární struktury jednoduše sestávají z uhlíků a vodíků spojených jednoduchými vazbami. Protože rozdíl v elektronegativitách mezi C a H je velmi malý, jedná se o nepolární sloučeniny.
Metan, CH4, nejmenší uhlovodík ze všech, má teplotu varu -161,7 ° C. Když se do skeletu přidají C a H, získají se další alkany s vyšší molekulovou hmotností.
Tímto způsobem vznikají etan (-88,6 ° C), butan (-0,5 ° C) a oktan (125,7 ° C). Všimněte si, jak se jejich body varu zvyšují, jak alkany zesilují.
Je to proto, že jejich elektronické mraky jsou polarizovatelnější a jejich struktury mají větší povrch, což zvyšuje kontakt mezi jejich molekulami..
Oktan, i když je nepolární sloučeninou, má vyšší teplotu varu než voda.
Halogeny a plyny
Londýnské síly jsou také přítomny v mnoha plynných látkách. Například molekuly Ndva, Hdva, COdva, Fdva, Cldva a všechny vzácné plyny interagují prostřednictvím těchto sil, protože představují homogenní elektrostatické rozdělení, které může okamžitě utrpět dipóly a vést k polarizaci.
Vzácné plyny jsou He (hélium), Ne (neon), Ar (argon), Kr (krypton), Xe (xenon) a Rn (radon). Zleva doprava se jejich body varu zvyšují se zvyšujícími se atomovými hmotnostmi: -269, -246, -186, -152, -108 a -62 ° C.
Halogeny také interagují prostřednictvím těchto sil. Fluor je plyn při pokojové teplotě stejně jako chlor. Brom s vyšší atomovou hmotou se za normálních podmínek vyskytuje jako načervenalá kapalina a jod nakonec vytváří fialovou pevnou látku, která rychle sublimuje, protože je těžší než jiné halogeny.
Reference
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 452-455.
- Angeles Mendez. (22. května 2012). Disperzní síly (z Londýna). Obnoveno z: quimica.laguia2000.com
- London Dispersion Forces. Obnoveno z: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22. června 2018). 3 typy mezimolekulárních sil. Obnoveno z: thoughtco.com
- Ryan Ilagan & Gary L Bertrand. Londýnské disperzní interakce. Převzato z: chem.libretexts.org
- ChemPages Netorials. Londýnské síly. Obnoveno z: chem.wisc.edu
- Kamereon. (22. května 2013). Gekoni: Gekon a síly Van der Waals. Obnoveno z: almabiologica.com



Zatím žádné komentáře