
Struktura, funkce, třídy a příklady glykoproteinů
The glykoproteiny nebo glykoproteiny jsou transmembránové proteiny, které jsou součástí velké rodiny membránových glykokonjugátů a jsou přítomny u zvířat, rostlin a mikroorganismů, jako jsou bakterie, kvasinky a archea.
Poprvé byly definovány v roce 1908 Výborem pro názvosloví proteinů Americké společnosti biochemiků a jsou výsledkem glykosidového spojení proteinu s částí sacharidů zvanou glukan..
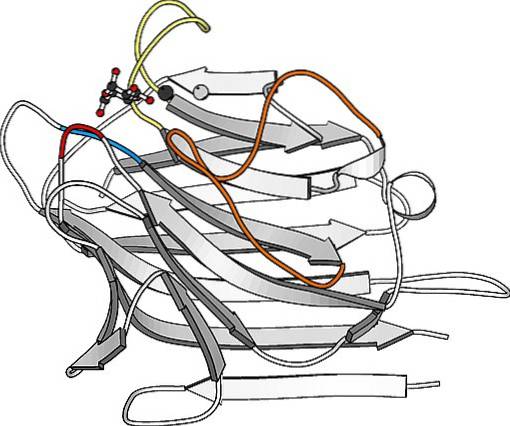
Jsou to bílkoviny, které jsou obzvláště hojné na povrchu plazmatické membrány mnoha buněk a tvoří důležitou součást vrstvy sacharidů, která je pokrývá a která se v mnoha případech nazývá glukokalyx..
Prekurzorové proteiny glykoproteinů jsou kovalentně modifikovány v endoplazmatickém retikulu a Golgiho komplexu mnoha eukaryot po jejich translaci, i když existují také případy glykosylace v cytosolu, ale jsou méně časté a vyskytují se pouze u jednoho typu cukru.
Glykosylace proteinů má často důležité funkční účinky na její aktivitu, protože se může podílet na skládání, a tedy na vytváření její terciární struktury.
Glykany mají pro buňku několik biologicky důležitých funkcí, protože mohou buňkám dodávat specificitu a účastnit se intracelulárních a mezibuněčných signálních procesů, protože jsou ligandy pro endogenní a exogenní receptory.
Glykoproteiny, stejně jako zbytek glykokonjugátů, jsou tak důležité, že buňka věnuje až 1% svého genomu glykosylačnímu aparátu a u lidí je více než 70% proteinů upraveno glykosylací.
Rejstřík článků
- 1 Struktura
- 2 funkce
- 2.1 Strukturální
- 2.2 Rozpoznávání buněk
- 2.3 Adheze buněk
- 2.4 Glykoproteiny jako terapeutické cíle
- 3 třídy
- 4 příklady
- 5 Reference
Struktura
Struktura glykoproteinů je studována na základě jejich aminokyselinové sekvence, glykosylačních míst v sekvenci a struktur glykánových částí, které se na těchto místech váží..
Oligosacharidové řetězce, které jsou spojeny glykosylací s těmito proteiny, jsou obecně velmi rozmanité, ale jsou krátké, protože nepřesahují 15 cukerných zbytků. Některé proteiny mají jediný oligosacharidový řetězec, ale jiné mohou mít více než jeden a tyto mohou být rozvětvené.
Spojení mezi oligosacharidy a proteiny nastává prostřednictvím anomerního uhlíku uhlohydrátu a hydroxylové skupiny (-OH) serinového nebo threoninového zbytku, v případě NEBO-glykosylací, nebo prostřednictvím amidového dusíku zbytku asparaginu, v případě N-glykosylace.
Takto vázané sacharidy mohou představovat až 70% molekulové hmotnosti glykoproteinu a vlastnosti sacharidové části (například velikost a náboj) mohou chránit některé proteiny před enzymatickou proteolýzou..
Stejný protein může mít v různých tkáních různé glykosylační vzorce, které z něj dělají odlišný glykoprotein, protože úplná struktura zahrnuje nejen aminokyselinové zbytky a jejich prostorová uspořádání, ale také oligosacharidy k nim připojené..
Mezi zbytky cukru, které se opakovaně vyskytují v glykoproteinech, patří: D-galaktóza, D-manóza, D-glukóza, L-fukóza, D-xylóza, L-arabinofuranóza, N-acetyl-D-glukosamin, N-acetyl-D- galaktosamin, některé kyseliny sialové a modifikace všech těchto látek.
Funkce
Strukturální
Ze strukturálního hlediska poskytují glykoproteiny sacharidové řetězce, které se podílejí na ochraně a mazání buněk, protože jsou schopné hydratovat a vytvářet viskózní látku, která odolává mechanickým a chemickým agresím.
Některé glykoproteiny se nacházejí také v bakteriích a archeaách a jsou to důležité složky S vrstvy, která je nejvzdálenější vrstvou buněčného krytu..
Kromě toho se také nacházejí jako složky bičíkových proteinů, které jsou součástí bičíkových vláken používaných jako pohybové orgány..
Rostliny také obsahují strukturní glykoproteiny, které se vyznačují složitými glykosylačními vzory a které lze nalézt jako součást struktury buněčné stěny nebo v extracelulární matrici..
Rozpoznávání buněk
Glykoproteiny mají důležité funkce jako rozpoznávací místa mezi buňkami, protože mnoho receptorů na buněčném povrchu je schopno rozpoznávat specifické oligosacharidové sekvence.
Příkladem mezibuněčného rozpoznávání, ke kterému dochází prostřednictvím oligosacharidových řetězců na buněčném povrchu, je případ rozpoznání mezi vajíčkem a spermatem, které je nezbytné pro to, aby k fenoménu oplodnění došlo v mnohobuněčných organismech se sexuální reprodukcí..
Krevní skupiny u lidí jsou určeny identitou cukrů připojených k glykoproteinům, které je specifikují. Protilátky a mnoho hormonů jsou také glykoproteiny a jejich funkce jsou nezbytné pro signalizaci a obranu těla.
Adheze buněk
T buňky savčího imunitního systému obsahují glykoprotein s adhezivními doménami známými jako CD2, který je klíčovou složkou imunitní stimulace, protože prostřednictvím svého receptoru, glykoproteinu CD58, zprostředkovává vazbu mezi lymfocyty a buňkami prezentujícími antigen..
Některé viry, které mají důležité patogenní funkce pro mnoho savců, včetně lidí, mají povrchové glykoproteiny, které fungují v procesech adheze virových částic k buňkám, které parazitují..
To je případ proteinu GP120 viru lidské získané imunodeficience nebo HIV, který interaguje s povrchovým proteinem lidských buněk známým jako GP41 a který spolupracuje se vstupem viru do buňky.
Stejným způsobem se mnoho glykosylovaných proteinů účastní důležitých procesů buněčné adheze, které probíhají v běžném životě buněk přítomných v mnoha tkáních mnohobuněčných organismů..
Glykoproteiny jako terapeutické cíle
Tyto komplexy protein-sacharid jsou preferovanými cíli pro mnoho patogenů, jako jsou paraziti a viry, a mnoho glykoproteinů s aberantními glykosylačními vzory má zásadní roli v autoimunitních onemocněních a rakovinách.
Z těchto důvodů se různí vědci ujali úkolu navrhnout tyto proteiny jako možné terapeutické cíle a pro návrh diagnostických metod, terapií nové generace a dokonce pro návrh vakcín..
Poučení
Klasifikace glykoproteinů je založena hlavně na povaze glykosidické vazby, která spojuje část bílkovin a sacharidů, a na vlastnostech spojených glykanů..
Podle zbytků cukru mohou existovat glykoproteiny s monosacharidy, disacharidy, oligosacharidy, polysacharidy a jejich deriváty. Někteří autoři zvažují klasifikaci glykoproteinů v:
- Proteoglykany, které jsou podtřídou ve skupině glykoproteinů, které obsahují v sacharidové části polysacharidy složené převážně z amino cukrů (glykosaminoglykany).
- Glykopeptidy, což jsou molekuly složené ze sacharidů vázaných na oligopeptidy tvořené aminokyselinami v jejich L a / nebo D konformacích.
- Glykoaminokyseliny, což jsou aminokyseliny spojené se sacharidem prostřednictvím jakéhokoli typu kovalentní vazby.
- Glykosyl aminokyseliny, což jsou aminokyseliny navázané na sacharidovou část prostřednictvím O-, N- nebo S-glykosidových vazeb.
V nomenklatuře těchto proteinů takto navázaných na uhlohydráty se používají předpony O-, N- a S- ke specifikaci, přes které vazby jsou cukry připojeny k polypeptidovému řetězci..
Příklady
- Glykoforin A je jedním z nejlépe studovaných glykoproteinů: je integrálním proteinem membrány erytrocytů (buněk nebo červených krvinek) a má 15 oligosacharidových řetězců kovalentně navázaných na aminokyselinové zbytky v N-koncové oblasti prostřednictvím vazeb NEBO-glykosidika a řetězec spojený vazbou N-glykosidový.
- Většina bílkovin v krvi jsou glykoproteiny a do této skupiny patří imunoglobuliny a mnoho hormonů.
- Laktalbumin, protein přítomný v mléce, je glykosylován, stejně jako mnoho pankreatických a lysozomálních proteinů.
- Lektiny jsou bílkoviny vázající sacharidy, a proto mají více rozpoznávacích funkcí.
- Musíme také zdůraznit mnoho živočišných hormonů, které jsou glykoproteiny; Mezi nimi lze zmínit lutropin (LH), follitropin (FSH) a thyrotropin (TSH), které se syntetizují v přední hypofýze, a choriový gonadotropin, který se produkuje v placentě lidí, primátů a koňovitých.
Tyto hormony mají reprodukční funkce, protože LH stimuluje steroidogenezi ve vaječnících a testikulárních Leydigových buňkách..
- Kolagen, hojný protein přítomný primárně v pojivových tkáních zvířat, představuje obrovskou rodinu glykoproteinů složených z více než 15 typů proteinů, které, i když mají mnoho společných charakteristik, jsou zcela odlišné.
Tyto proteiny obsahují „nekolagenní“ části, z nichž některé jsou tvořeny sacharidy..
- Extensiny jsou rostlinné proteiny, které se skládají ze sítě nerozpustných glykoproteinů, které jsou bohaté na hydroxyprolinové a serinové zbytky. Nacházejí se ve stěně rostlinných buněk a předpokládá se, že působí jako obrana proti různým druhům stresu a patogenům..
- Rostliny také obsahují proteiny podobné lektinu a jejich zvláštním příkladem jsou bramborové lektiny, které zjevně mají schopnost aglutinovat krevní buňky, jako jsou erytrocyty..
- V neposlední řadě lze jmenovat muciny, což jsou glykoproteiny vylučované ve sliznici a jsou součástí slin u zvířat, plnící mazací a signalizační funkce, zejména.
Reference
- Montreuil, J., Vliegenthart, J., & Schachter, H. (1995). Glykoproteiny. (A. Neuberger a L. Deenen, ed.). Elsevier.
- Nelson, D. L. a Cox, M. M. (2009). Lehningerovy principy biochemie. Edice Omega (5. vydání). https://doi.org/10.1007/s13398-014-0173-7.2
- Struwe, W., & Cosgrave, E. (2011). Funkční a strukturní proteomika glykoproteinů. (R. Owens a J. Nettleship, ed.). Londýn: Springer.
- Voet, D. a Voet, J. (2006). Biochemie (3. vyd.). Panamerican Medical Editorial.
- Wittman, V. (2007). Glykopeptidy a glykoproteiny. Syntéza, struktura a aplikace. (V. Balzani, J.-M. Lehn, A. de Meijere, S. Ley, K. Houk, S. Schreiber, J. Thiem, Eds.). Lipsko: Springer Science + Business Media, LLC.


Zatím žádné komentáře