
Typy, proces a funkce proteinové glykosylace

The glykosylace proteinů Jedná se o posttranslační modifikaci, která spočívá v přidání lineárních nebo rozvětvených oligosacharidových řetězců k proteinu. Výsledné glykoproteiny jsou obecně povrchové proteiny a proteiny sekreční dráhy..
Glykosylace je jednou z nejběžnějších peptidových modifikací mezi eukaryotickými organismy, ale bylo prokázáno, že se vyskytuje také u některých druhů archaeí a bakterií..
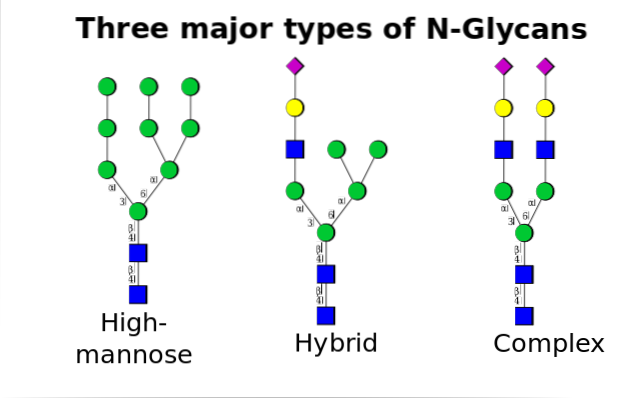
U eukaryot se tento mechanismus vyskytuje mezi endoplazmatickým retikulem (ER) a Golgiho komplexem, přičemž se do regulačních procesů a do tvorby kovalentních vazeb protein + oligosacharid zapojují různé enzymy..
Rejstřík článků
- 1 Druhy glykolýzy
- 1.1 N-glykosylace
- 1.2 O-glykosylace
- 1.3 C-mannosylace
- 1.4 Glypiace (z angličtiny „Glypiation“)
- 2 Zpracovat
- 2.1 U eukaryot
- 2.2 U prokaryot
- 3 funkce
- 3.1 Důležitost
- 4 Odkazy
Druhy glykolýzy
V závislosti na vazebném místě oligosacharidu k proteinu lze glykosylaci rozdělit do 4 typů:
N-glykosylace
Je to nejběžnější ze všech a vyskytuje se, když se oligosacharidy vážou na dusík amidové skupiny asparaginových zbytků v motivu Asn-X-Ser / Thr, kde X může být jakákoli aminokyselina kromě prolin.
NEBO-glykosylace
Když jsou sacharidy připojeny k hydroxylové skupině serinu, threoninu, hydroxylysinu nebo tyrosinu. Jedná se o méně častou modifikaci a jsou příklady proteinů, jako je kolagen, glykoforin a muciny..
C-manosilace
Skládá se z přidání zbytku manózy, který se váže na protein vazbou C-C s C2 indolové skupiny v tryptofanových zbytcích.
Glipiation (z anglického “Glypiace ")
Polysacharid působí jako můstek k připojení proteinu ke kotvě glykosylfosfatidylinositolu (GPI) na membráně.
Proces
U eukaryot
The N-glykosylace je ta, která byla studována podrobněji. V savčích buňkách proces začíná v hrubém ER, kde se předem vytvořený polysacharid váže na proteiny, jakmile se dostanou z ribozomů..
Uvedený prekurzorový polysacharid se skládá ze 14 zbytků cukru, konkrétně: 3 zbytky glukózy (Glc), 9 manózy (Man) a 2 N-acetylglukosamin (GlcNAc).
Tento předchůdce je běžný u rostlin, zvířat a jednobuněčných eukaryotických organismů. Je vázán na membránu díky vazbě s molekulou dolicholu, což je izoprenoidový lipid zabudovaný do membrány ER..
Po jeho syntéze je oligosacharid přenesen enzymatickým komplexem oligosakryltransferázy na asparaginový zbytek obsažený v tri-peptidové sekvenci Asn-X-Ser / Thr proteinu, zatímco je translatován.
Tři Glc zbytky na konci oligosacharidu slouží jako signál pro správnou syntézu oligosacharidů a jsou štěpeny společně s jedním ze zbytků Man před tím, než je protein přenesen do Golgiho aparátu pro další zpracování..
Jakmile jsou v Golgiho aparátu, mohou být oligosacharidové části připojené k glykoproteinům modifikovány přidáním galaktózy, kyseliny sialové, fukózy a mnoha dalších zbytků, čímž se získají řetězce mnohem větší rozmanitosti a složitosti..
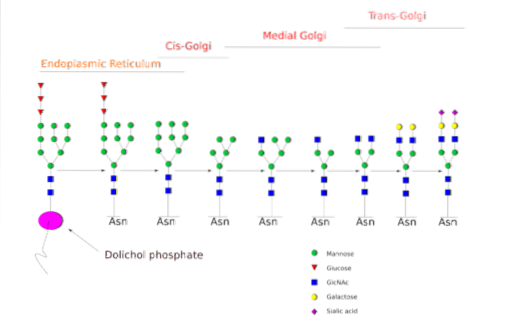
Enzymatický aparát, který je potřebný k provádění glykosylačních procesů, zahrnuje četné glykosyltransferázy pro přidání cukrů, glykosidázy pro jejich odstranění a různé nukleotidové cukerné transportéry pro příspěvek zbytků použitých jako substráty..
U prokaryot
Bakterie nemají intracelulární membránové systémy, takže k tvorbě počátečního oligosacharidu (pouze 7 zbytků) dochází na cytosolické straně plazmatické membrány..
Uvedený prekurzor je syntetizován na lipidu, který je potom translokován flipázou závislou na ATP do periplazmatického prostoru, kde dochází ke glykosylaci..
Dalším důležitým rozdílem mezi eukaryotickou a prokaryotickou glykosylací je to, že enzym oligosacharid transferáza (oligosacaryltransferáza) z bakterií může přenášet zbytky cukru na volné části již složených proteinů, ne tak, jak jsou překládány ribozomy..
Navíc peptidový motiv rozpoznávaný tímto enzymem není stejná eukaryotická tri-peptidová sekvence..
Funkce
The N-oligosacharidy připojené k glykoproteinům slouží různým účelům. Například některé proteiny vyžadují tuto posttranslační modifikaci, aby se dosáhlo správného skládání jejich struktury..
Pro ostatní poskytuje stabilitu, buď vyloučením proteolytické degradace, nebo proto, že tato část je pro ně nezbytná k plnění jejich biologické funkce..
Protože oligosacharidy mají silný hydrofilní charakter, jejich kovalentní přidání k proteinu nutně modifikuje jeho polaritu a rozpustnost, což může mít z funkčního hlediska význam..
Jakmile jsou oligosacharidy připojeny k membránovým proteinům, jsou cennými nosiči informací. Podílejí se na procesech signalizace, komunikace, rozpoznávání, migrace a adheze buněk.
Mají důležitou roli při srážení krve, hojení a imunitní odpovědi, stejně jako při zpracování kontroly kvality bílkovin, která je pro buňku závislá na glykanu a nepostradatelná..
Důležitost
S glykosylací bílkovin u lidí je spojeno nejméně 18 genetických onemocnění, z nichž některá zahrnují špatný fyzický a duševní vývoj, zatímco jiná mohou být smrtelná.
Roste počet objevů souvisejících s glykosylačními chorobami, zejména u pediatrických pacientů. Mnoho z těchto poruch je vrozených a souvisí s defekty spojenými s počátečními fázemi tvorby oligosacharidů nebo s regulací enzymů, které se na těchto procesech podílejí..
Jelikož velká část glykosylovaných proteinů tvoří glykokalyx, roste zájem o ověření, že mutace nebo změny v glykosylačních procesech mohou souviset se změnou v mikroprostředí nádorových buněk, a tak podporovat progresi nádorů a vývoj metastázy u pacientů s rakovinou.
Reference
- Aebi, M. (2013). N-vázaná proteinová glykosylace v ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Glykosylace proteinů ve vývoji a nemoci. BioEssays, dvacet jedna(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Molekulární buněčná biologie (5. vydání). Freeman, W. H. & Company.
- Luckey, M. (2008). Membránová strukturní biologie: s biochemickými a biofyzikálními základy. Cambridge University Press. Citováno z www.cambrudge.org/9780521856553
- Nelson, D. L. a Cox, M. M. (2009). Lehningerovy principy biochemie. Edice Omega (5. vydání).
- Nothaft, H., & Szymanski, C. M. (2010). Glykosylace proteinů v bakteriích: Sladší než kdy dříve. Příroda Recenze Mikrobiologie, 8(11), 765-778.
- Ohtsubo, K., & Marth, J. D. (2006). Glykosylace v buněčných mechanismech zdraví a nemoci. Buňka, 126(5), 855-867.
- Spiro, R. G. (2002). Glykosylace proteinů: povaha, distribuce, enzymatická tvorba a důsledky glykopeptidových vazeb na choroby. Glykobiologie, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Glykosylace proteinů u rakoviny. Roční přehled patologie: mechanismy nemocí, 10(1), 473-510.
- Strasser, R. (2016). Glykosylace rostlinných bílkovin. Glykobiologie, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Kontrola kvality skládání proteinů zaměřená na glykosylaci. Nature Reviews Molecular Cell Biology, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Kontrola kvality glykosylace podle Golgiho struktury. Journal of Molecular Biology, 428(16), 3183-3193.


Zatím žádné komentáře