
Chemická hybridizace sp, sp2, sp3
The chemická hybridizace jedná se o „směs“ atomových orbitalů, jejíž koncept představil chemik Linus Pauling v roce 1931, aby pokryl nedokonalosti teorie valenciaských teorií (TEV). Jaké nedokonalosti? Jsou to: molekulární geometrie a ekvivalentní délky vazeb v molekulách, jako je methan (CH4).
Podle TEV tvoří atomové orbitaly C v metanu čtyři vazby σ se čtyřmi atomy H. Orbitaly 2p s tvary form (C) jsou C na sebe kolmé, takže H by mělo být asi několik od ostatních Úhel 90 °.
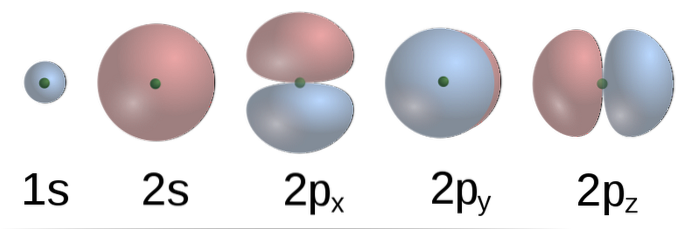
Navíc 2s (sférický) orbitál C se váže na 1s orbitál H v úhlu 135 ° vzhledem k ostatním třem H. Avšak experimentálně bylo zjištěno, že úhly v CH4 jsou 109,5 ° a že navíc jsou délky vazeb CH ekvivalentní.
Abychom to vysvětlili, je třeba uvažovat o kombinaci původních atomových orbitalů za vzniku čtyř degenerovaných hybridních orbitalů (se stejnou energií). Zde vstupuje do hry chemická hybridizace. Jaké jsou hybridní orbitaly? Záleží na atomových orbitálech, které je generují. Vykazují také směs elektronických charakteristik.
Rejstřík článků
- 1 sp3 hybridizace
- 1.1 Výklad
- 1.2 Odchylky vazebných úhlů
- 2 sp2 hybridizace
- 3 sp hybridizace
- 4 Odkazy
Sp hybridizace3
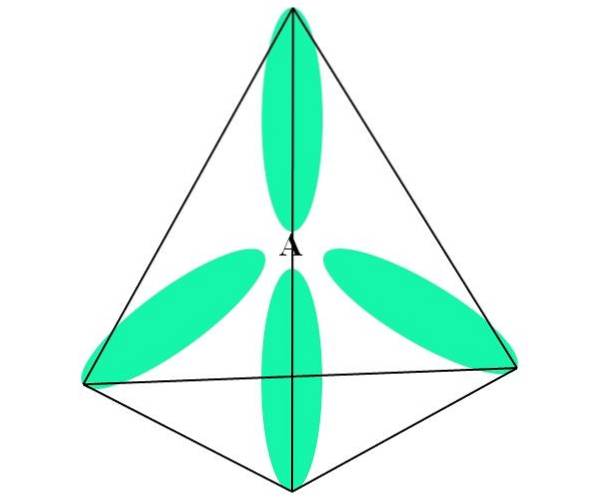
V případě CH4, hybridizace C je sp3. Z tohoto přístupu je molekulární geometrie vysvětlena čtyřmi sp orbitály3 109,5 ° od sebe a směřující k vrcholům čtyřstěnu.
V horním obrázku vidíte, jak sp orbitaly3 (zeleně zbarvené) vytvoří kolem atomu čtyřboké elektronické prostředí (A, což je C pro CH4).
Proč 109,5 ° a ne jiné úhly, aby bylo možné „nakreslit“ jinou geometrii? Důvodem je to, že tento úhel minimalizuje elektronické odpuzování čtyř atomů, které se vážou na A.
Tedy molekula CH4 může být reprezentován jako čtyřstěn (čtyřboká molekulární geometrie).
Pokud by místo H vytvořil C vazby s jinými skupinami atomů, jaká by pak byla jejich hybridizace? Dokud uhlík vytvoří čtyři vazby σ (C-A), bude jejich hybridizace sp3.
Lze tedy předpokládat, že v jiných organických sloučeninách, jako je CH3OH, CCI4, C (CH3)4, C6H12 (cyklohexan) atd., uhlík má sp hybridizaci3.
To je zásadní pro skicování organických struktur, kde jednoduché vázané uhlíky představují body divergence; to znamená, že struktura nezůstává v jedné rovině.
Výklad
Jaká je nejjednodušší interpretace těchto hybridních orbitálů bez řešení matematických aspektů (vlnové funkce)? Sp orbitály3 naznačují, že vznikly čtyřmi orbitaly: jedním sa třemi p.
Protože se předpokládá, že kombinace těchto atomových orbitalů je ideální, čtyři sp orbitaly3 výsledné jsou identické a zaujímají různou orientaci v prostoru (například na orbitálech pX, pY A strz).
Výše uvedené je použitelné pro zbytek možných hybridizací: počet vytvořených hybridních orbitalů je stejný jako počet atomových orbitalů, které jsou kombinovány. Například sp hybridní orbitaly3ddva jsou vytvořeny ze šesti atomových orbitalů: jeden s, tři p a dva d.
Odchylky úhlu vazby
Podle teorie Valencia Shell Electronic Pair Repulsion Theory (RPECV) zaujímá pár volných elektronů větší objem než vázaný atom. To způsobí, že se články budou pohybovat od sebe, čímž se sníží elektronické napětí a odchýlí se úhly od 109,5 °:
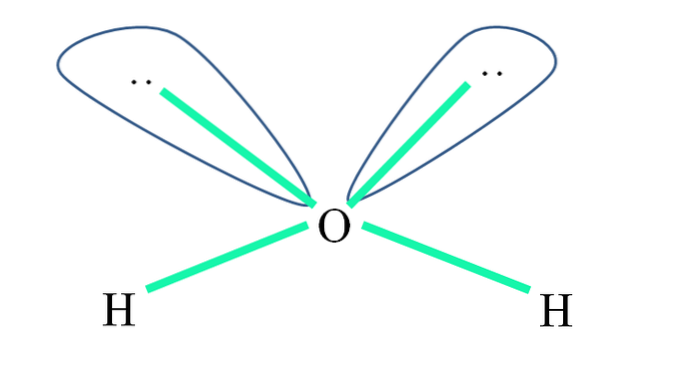
Například v molekule vody jsou atomy H navázány na sp orbitály3 (zeleně) a podobně nesdílené páry elektronů „:“ zaujímají tyto orbitaly.
Odpudivosti těchto párů elektronů jsou obvykle reprezentovány jako „dva globusy s očima“, které díky svému objemu odpuzují dvě σ O-H vazby.
Ve vodě jsou tedy vazebné úhly ve skutečnosti 105 °, místo 109,5 ° očekávaného pro čtyřboká geometrie..
Jakou geometrii pak dělá HdvaNEBO? Má úhlovou geometrii. Proč? Protože i když je elektronická geometrie čtyřboká, dva páry nesdílených elektronů ji narušují na úhlovou molekulární geometrii.
Sp hybridizacedva
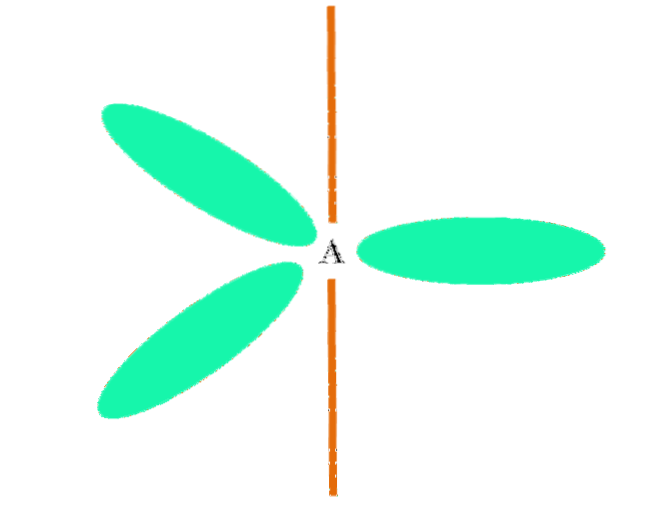
Když atom kombinuje dva orbitaly p a jeden s, generuje tři hybridní sp orbitalydva; jeden orbitál však zůstává nezměněn (protože jsou tři), který je v horním obrázku znázorněn jako oranžová lišta.
Tady, tři sp orbitalydva jsou zbarveny zeleně, aby zvýraznily jejich odlišnost od oranžového pruhu: „čistý“ orbitál.
Atom se sp hybridizacídva lze vizualizovat jako ploché trigonální dno (trojúhelník nakreslený sp orbitálydva zelená), s vrcholy oddělenými 120 ° úhly a kolmými na lištu.
A jakou roli hraje čistý orbitál? Vytvoření dvojné vazby (=). Sp orbitálydva umožňují vznik tří vazeb σ, zatímco čistá p orbitální jedna vazba π (dvojitá nebo trojná vazba znamená jednu nebo dvě vazby π).
Například nakreslit karbonylovou skupinu a strukturu molekuly formaldehydu (HdvaC = O), pokračuje takto:
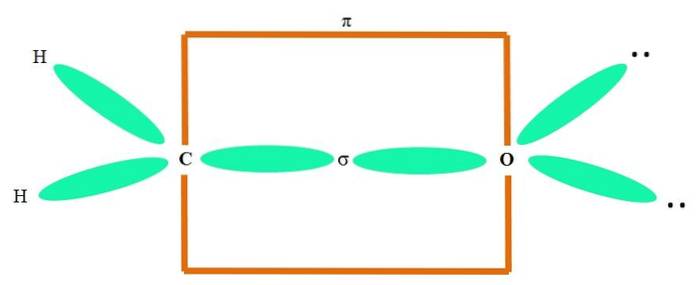
Sp orbitálydva jak C, tak O tvoří vazbu σ, zatímco jejich čisté orbitaly tvoří vazbu π (oranžový obdélník).
Je vidět, jak se zbytek elektronových skupin (atomy vodíku a nesdílené páry elektronů) nachází na ostatních sp orbitálech.dva, oddělené 120 °.
Sp hybridizace
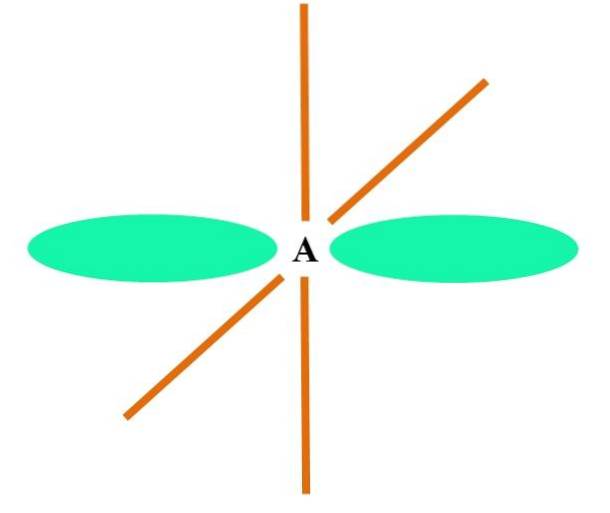
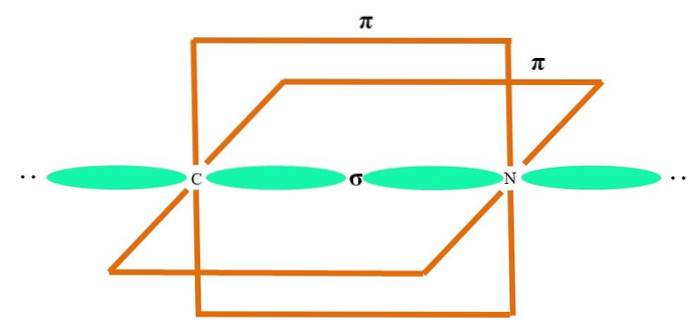
Na horním obrázku je znázorněn atom A s hybridizací sp. Zde se orbitál s orbitálem p spojí a vzniknou dva degenerované sp orbitaly. Nyní však dva čisté p orbitaly zůstávají nezměněny, což umožňuje A vytvořit dvě dvojné vazby nebo jednu trojnou vazbu (≡).
Jinými slovy: pokud C vyhovuje struktuře (= C = nebo C≡C), pak je jeho hybridizace sp. U jiných méně ilustrativních atomů - jako jsou přechodové kovy - je popis elektronických a molekulárních geometrií komplikovaný, protože jsou uvažovány také d orbitaly a dokonce i f orbitaly..
Hybridní orbitaly jsou od sebe vzdáleny 180 °. Z tohoto důvodu jsou vázané atomy uspořádány v lineární molekulární geometrii (B-A-B). Nakonec spodní obrázek ukazuje strukturu anionu kyanidu:
Reference
- Sven. (3. června 2006). S-p-orbitaly. [Postava]. Citováno dne 24. května 2018 z: commons.wikimedia.org
- Richard C. Banks. (Květen 2002). Lepení a hybridizace. Citováno 24. května 2018 z: chemistry.boisestate.edu
- James. (2018). Hybridizační zkratka. Citováno dne 24. května 2018 z: masterorganicchemistry.com
- Dr. Ian Hunt. Katedra chemie, University of Calgary. hybridizace sp3. Citováno 24. května 2018 z: chem.ucalgary.ca
- Chemická vazba II: Molekulární geometrie a hybridizace atomových orbitálů Kapitola 10. [PDF]. Citováno dne 24. května 2018 z: wou.edu
- Quimitube. (2015). Kovalentní vazba: Úvod do atomové orbitální hybridizace. Citováno dne 24. května 2018 z: quimitube.com
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., Str. 51). Mc Graw Hill.

Zatím žádné komentáře