
Vlastnosti alifatických uhlovodíků, názvosloví, reakce, typy
The Alifatické uhlovodíky jsou všechny ty, kterým chybí aromatičnost, nikoli v čichovém smyslu, ale s ohledem na chemickou stabilitu. Klasifikace uhlovodíků tímto způsobem je v dnešní době příliš nejednoznačná a nepřesná, protože nediskriminuje různé druhy uhlovodíků, které nejsou aromatické..
Máme tedy alifatické uhlovodíky a aromatické uhlovodíky. Ty jsou rozpoznány podle jejich základní jednotky: benzenového kruhu. Ostatní mohou naopak přijmout jakoukoli molekulární strukturu: lineární, rozvětvenou, cyklickou, nenasycenou, polycyklickou; pokud nemají konjugované systémy jako benzen.

Termín „alifatický“ se zrodil z řeckého slova „aleifar“, což znamená tuk, označovaný také jako oleje. Proto byla v 19. století tato klasifikace přiřazena uhlovodíkům získávaným z olejových extraktů; zatímco aromatické uhlovodíky byly extrahovány ze stromových pryskyřic a vonné.
Jak se však upevňovaly základy organické chemie, bylo zjištěno, že existuje chemická vlastnost, která odlišuje uhlovodíky, ještě důležitější než jejich přírodní zdroje: aromatičnost (a ne vůně).
Tímto způsobem přestali být alifatickými uhlovodíky pouze ty, které se získávaly z tuků, aby to byly všechny ty, kterým chybí aromatičnost. V této rodině máme alkany, alkeny a alkyny, bez ohledu na to, zda jsou lineární nebo cyklické. Proto je „alifatický“ považován za nepřesný; i když je užitečné zabývat se některými obecnými aspekty.
Například když řeknete alifatické „konce“ nebo „řetězce“, máte na mysli molekulární oblasti, kde chybí aromatické kruhy. Ze všech alifatických uhlovodíků je podle definice nejjednodušší metan, CH4; zatímco benzen je nejjednodušší z aromatických uhlovodíků.
Rejstřík článků
- 1 Vlastnosti alifatických uhlovodíků
- 2 Názvosloví
- 3 Reakce
- 3.1 Spalování
- 3.2 Doplnění
- 3.3 Halogenace
- 3.4 Praskání
- 4 typy
- 5 použití
- 6 příkladů
- 7 Reference
Vlastnosti alifatických uhlovodíků
Vlastnosti alifatických uhlovodíků se liší v různé míře podle toho, které z nich jsou uvažovány. Existují nízkomolekulární a vysokomolekulární hmoty, stejně jako lineární, rozvětvené, cyklické nebo polycyklické, dokonce i ty, které mají úžasné trojrozměrné struktury; jako u kubánského tvaru krychle.
Je však možné zmínit několik obecných zásad. Většina alifatických uhlovodíků jsou hydrofobní a nepolární plyny nebo kapaliny, přičemž některé jsou nepolárnější než jiné, protože jsou zahrnuty i ty, jejichž uhlíkové řetězce obsahují atomy halogenu, kyslíku, dusíku nebo síry..
Stejně tak se jedná o hořlavé sloučeniny, protože jsou citlivé na oxidaci ve vzduchu s minimálním zdrojem tepla. Tato vlastnost se stává nebezpečnější, když k ní přidáme její vysokou těkavost, kvůli slabým disperzním interakcím, které udržují alifatické molekuly pohromadě..
Vidíme to například v butanu, plynu, který se může poměrně snadno zkapalnit jako propan. Oba jsou vysoce těkavé a hořlavé, což z nich činí aktivní složky v kuchyňském plynu nebo kapesních zapalovačích..
Tato těkavost má samozřejmě tendenci snižovat se zvyšující se molekulovou hmotností a uhlovodík produkuje stále viskóznější a olejovité kapaliny..
Nomenklatura
Nomenklatura uhlovodíků se liší ještě více než jejich vlastnosti. Pokud se jedná o alkany, alkeny nebo alkyny, postupuje se podle stejných pravidel stanovených IUPAC: vyberte nejdelší řetězec a nejnižší čísla indikátorů přiřaďte nejsubstituovanějšímu konci nebo nejreaktivnějším heteroatomům nebo skupinám.
Tímto způsobem je známo, na kterém uhlíku se nachází každý substituent, nebo dokonce nenasycení (dvojné nebo trojné vazby). V případě cyklických uhlovodíků před názvem následují substituenty uvedené v abecedním pořadí, za nimiž následuje slovo „cyklus“, přičemž se počítají počty uhlíků, které jej obsahují..
Zvažte například následující dva cyklohexany:
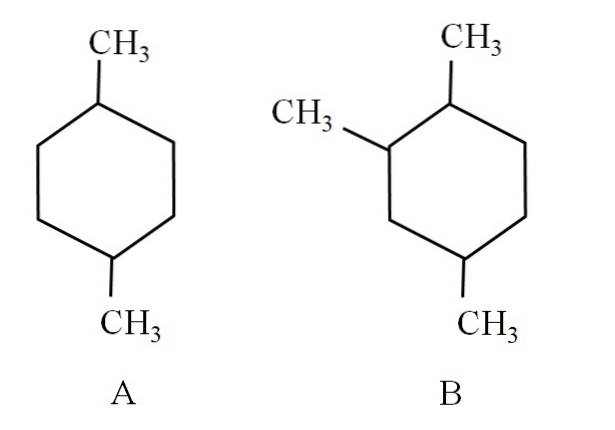
Cyklohexan A se nazývá 1,4-dimethylcyklohexan. Pokud by kruh obsahoval pět atomů uhlíku, byl by to 1,4-dimethylcyklopentan. Mezitím se cyklohexan B nazývá 1,2,4-trimethylcyklohexan, a nikoli 1,4,6-cyklohexan, protože se snaží používat nejnižší ukazatele.
Nomenklatura se nyní může velmi komplikovat pro uhlovodíky s bizarními strukturami. Pro ně existují konkrétnější pravidla, která musí být vysvětlena samostatně a pečlivě; jako u dienů, terpenů, polyenů a polycyklických sloučenin.
Reakce
Spalování
Naštěstí jsou reakce pro tyto uhlovodíky méně rozmanité. Jeden z nich již byl zmíněn: snadno hoří, produkuje oxid uhličitý a vodu, stejně jako další oxidy nebo plyny v závislosti na přítomnosti heteroatomů (Cl, N, P, O atd.). Avšak COdva a HdvaNebo jsou hlavními produkty spalování.
Přidání
Pokud představují nenasycení, mohou podstoupit adiční reakce; to znamená, že začleňují malé molekuly do svých páteří jako substituenty podle konkrétního mechanismu. Mezi těmito molekulami máme vodu, vodík a halogeny (F.dva, Cldva, Brdva a jádva).
Halogenace
Na druhou stranu, alifatické uhlovodíky pod dopadem ultrafialového záření (hv) a teplo může rozbít vazby C-H a vyměnit je za vazby C-X (C-F, C-Cl atd.). Jedná se o halogenační reakci, kterou lze pozorovat u alkanů s velmi krátkým řetězcem, jako je methan nebo pentan..
Praskání
Další reakcí, kterou mohou alifatické uhlovodíky, zejména alkany s dlouhým řetězcem, podstoupit, je tepelné štěpení. Spočívá v dodávce intenzivního tepla, takže tepelná energie rozbíjí vazby C-C, a tak se z malých molekul tvoří malé molekuly, které jsou cennější na trhu s palivem..
Čtyři výše uvedené reakce jsou hlavními reakcemi, kterým může alifatický uhlovodík projít, přičemž spalování je nejdůležitější ze všech, protože nediskriminuje žádnou sloučeninu; vše bude hořet v přítomnosti kyslíku, ale ne všechny přidají molekuly nebo se rozpadnou na malé molekuly.
Typy
Alifatické uhlovodíky sdružují nekonečné množství sloučenin, které jsou zase klasifikovány konkrétnějším způsobem, což naznačuje stupeň jejich nenasycenosti a typ struktury, kterou mají..
Podle toho, jak jsou nenasycené, máme alkany (nasycené), alkeny a alkyny (nenasycené).
Alkany se vyznačují tím, že mají jednoduché vazby C-C, zatímco u alkenů a alkynů pozorujeme vazby C = C a C≡C. Velmi obecným způsobem jejich vizualizace je považovat uhlíkové kostry alkanů za klikaté a ohnuté řetězce, které jsou „čtverci“ pro alkeny a „přímkami“ pro alkyny.
To je způsobeno skutečností, že dvojné a trojné vazby představují ve svých rotacích energii a sterické omezení a „zpevňují“ jejich struktury..
Alkany, alkeny a alkyny mohou být rozvětvené, cyklické nebo polycyklické. Proto se za alifatické uhlovodíky považují mimo jiné cykloalkany, cykloalkeny, cykloalkiny a sloučeniny, jako je dekalin (bicyklická struktura), adamantan (podobně jako baseballová čepice), heptalen, gonan..
Další typy uhlovodíků pocházejí z alkenů, jako jsou dieny (se dvěma dvojnými vazbami), polyeny (s mnoha střídavými dvojnými vazbami) a terpeny (sloučeniny odvozené od isoprenu, dienu).
Aplikace
Opět se použití těchto uhlovodíků může lišit v závislosti na tom, o kterém z nich se uvažuje. V sekcích vlastností a reakcí však bylo objasněno, že všechny hoří, a to nejen za účelem uvolnění plynných molekul, ale také světla a tepla. Jedná se tedy o zásobníky energie, které slouží jako zdroje paliv nebo tepla..
Proto se používají jako součást složení benzínu, pro zemní plyn, v Bunsenových hořácích a obecně k tomu, aby byly schopny zapálit oheň..
Jedním z nejpozoruhodnějších příkladů je acetylen, HC ,CH, jehož spalování umožňuje excitaci kovových iontů vzorku v atomové absorpční spektrometrii prováděné analytickými testy. Výsledný oheň lze také použít ke svařování.
Jako extrakční rozpouštědla pro tuky se často používají kapalné alifatické uhlovodíky, jako jsou parafiny. Jeho rozpouštědlový účinek lze navíc použít k odstranění skvrn, emailů, barev nebo jednoduše k přípravě roztoků určité organické sloučeniny.
Ty s nejvyšší molekulovou hmotností, ať viskózní nebo pevné, se používají k výrobě pryskyřic, polymerů nebo léků.
Pokud jde o termín „alifatický“, často se používá k označení těch oblastí v makromolekule, které postrádají aromatičnost. Například asfaltény jsou povrchně popsány jako aromatické jádro s alifatickými řetězci.
Příklady
Nejprve se říkalo, že metan je nejjednodušší z alifatických uhlovodíků. Poté následuje propan, CH3CHdvaCH3, butan, CH3CHdvaCHdvaCH3, pentan, CH3CHdvaCHdvaCHdvaCH3, oktan, nonan, děkan a tak dále, s delšími a delšími alkany.
Totéž platí pro ethylen, CHdva= CHdva, propen, CH3CH = CHdva, buten, CH3CHdvaCH = CH3, a pro zbytek alkynů. Pokud existují dvě dvojné vazby, jsou to dieny, a pokud jsou více než dvě, polyeny. Podobně mohou být ve stejné kostře dvojné a trojné vazby, což zvyšuje strukturální složitost..
Z cykloalkanů můžeme zmínit cyklopropan, cyklobutan, cyklopentan, cyklohexan, cykloheptan, cyklooktan, stejně jako cyklohexen a cyklohexin. Rozvětvené deriváty se zase získávají ze všech těchto uhlovodíků, přičemž dostupné příklady se ještě znásobují (například 1,4-dimethylcyklohexan).
Z nejreprezentativnějších terpenů máme limonen, mentol, pinen, vitamin A, skvalen atd. Polyethylen je polymer nasycený jednotkami -CHdva-CHdva-, je to tedy také příklad těchto uhlovodíků. Další příklady již byly citovány v předchozích částech.
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Helmenstine, Anne Marie, Ph.D. (22. srpna 2019). Definice alifatických uhlovodíků. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Alifatická sloučenina. Obnoveno z: en.wikipedia.org
- Chemistry LibreTexts. (20. srpna 2019). Alifatické uhlovodíky. Obnoveno z: chem.libretexts.org
- Elizabeth Wyman. (2019). Alifatické uhlovodíky: Definice a vlastnosti. Studie. Obnoveno z: study.com



Zatím žádné komentáře