
Struktura hydroxidu hlinitého, vlastnosti, použití, rizika
The hydroxid hlinitý je anorganická sloučenina, jejíž chemický vzorec je Al (OH)3. Na rozdíl od jiných hydroxidů kovů je amfoterní, schopný reagovat nebo se chovat jako kyselina nebo báze, v závislosti na médiu. Je to bílá pevná látka zcela nerozpustná ve vodě, takže nachází použití jako složka antacid.
Jako Mg (OH)dva nebo brucit, se kterým sdílí určité chemické a fyzikální vlastnosti, v čisté formě vypadá jako matná, amorfní pevná látka; ale když krystalizuje s některými nečistotami, získává krystalické formy, jako by to byly perly. Mezi těmito minerály jsou přírodní zdroje Al (OH)3, gibbsite je nalezen.

Kromě gibbsitu existují také minerály bayerit, nordstrandit a doleyit, které tvoří čtyři polymorfy hydroxidu hlinitého. Strukturálně jsou si navzájem velmi podobné, těžko se liší způsobem, jakým jsou vrstvy nebo vrstvy iontů umístěny nebo spojeny, stejně jako typem obsažených nečistot..
Regulací parametrů pH a syntézy lze připravit kterýkoli z těchto polymorfů. Některé chemické druhy, které nás zajímají, mohou být také interkalovány mezi jeho vrstvami, takže vznikají interkalační materiály nebo sloučeniny. To představuje použití technologičtějšího přístupu pro Al (OH)3. Jeho další použití jsou jako antacida.
Na druhou stranu se používá jako surovina pro získání oxidu hlinitého a jeho nanočástice se používají jako katalytický nosič..
Rejstřík článků
- 1 Struktura
- 1.1 Vzorec a osmistěn
- 1.2 Polymorfy
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Hustota
- 2.4 Teplota tání
- 2.5 Rozpustnost ve vodě
- 2.6 Produkt rozpustnosti
- 2.7 Amfoterismus
- 3 Názvosloví
- 4 použití
- 4.1 Surovina
- 4.2 Katalytické podpěry
- 4.3 Interkalační sloučeniny
- 4.4 Zpomalovač hoření
- 4.5 Léčivé
- 4.6 Adsorbent
- 5 Rizika
- 6 Reference
Struktura
Vzorec a osmistěn
Chemický vzorec Al (OH)3 značí najednou, že vztah Al3+: ACH- je 1: 3; to znamená, že existují tři OH anionty- pro každý Al kation3+, což je stejné, jako když říkáme, že třetina jeho iontů odpovídá hliníku. Al3+ a OH- interagují elektrostaticky, dokud jejich přitažlivost-odpudivost neurčí hexagonální krystal.
Al3+ nemusí být nutně obklopen třemi OH- ale šest; proto mluvíme o koordinačním osmistěnu, Al (OH)6, ve kterých existuje šest interakcí Al-O. Každý osmistěn představuje jednotku, ze které je postaven krystal, a řada z nich přijímá triclinické nebo monoklinické struktury.
Spodní obrázek částečně představuje Al (OH) osmistěn6, protože pro Al jsou pozorovány pouze čtyři interakce3+ (světle hnědé koule).
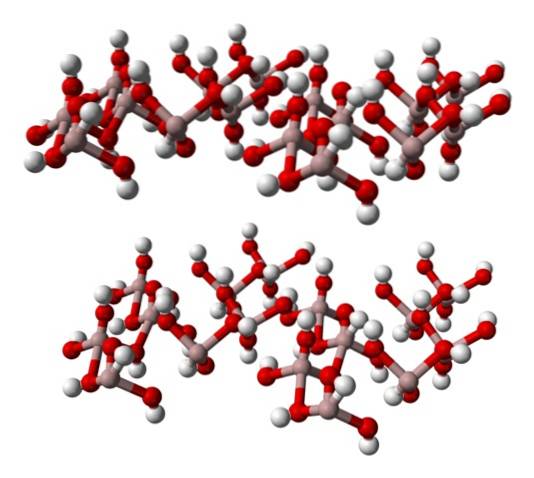
Pokud je tato struktura pečlivě sledována, což odpovídá struktuře minerálního gibbsitu, je vidět, že bílé koule tvoří „tváře“ nebo povrchy iontových vrstev; to jsou atomy vodíku iontů OH-.
Všimněte si také, že existuje vrstva A a další B (prostorově nejsou identické), spojené vodíkovými vazbami..
Polymorfy
Vrstvy A a B nejsou vždy spojeny stejným způsobem, stejně jako se může změnit jejich fyzické prostředí nebo hostitelské ionty (soli). V důsledku toho Al (OH) krystaly3 se liší ve čtyřech mineralogických nebo v tomto případě polymorfních formách.
Hydroxid hlinitý má pak až čtyři polymorfy: gibbsit nebo hydrargillit (monoklinický), bayerit (monoklinický), doyleit (triklinický) a nordstrandit (triklinický). Z těchto polymorfů je gibbsit nejstabilnější a nejhojnější; ostatní jsou klasifikovány jako vzácné minerály.
Pokud by byly krystaly pozorovány pod mikroskopem, bylo by vidět, že jejich geometrie je šestihranná (i když poněkud nepravidelná). Hodnota pH hraje důležitou roli při růstu těchto krystalů a na výsledné struktuře; to znamená, že při daném pH může být vytvořen polymorf nebo jiný.
Například pokud médium, kde se vysráží Al (OH)3 má pH nižší než 5,8; je vytvořen gibbsit; zatímco je-li pH vyšší než tato hodnota, vzniká bayerit.
Ve více základních médiích se obvykle tvoří krystaly nordstranditu a doyleitu. Jelikož je to nejhojnější gibbsit, je to skutečnost, která odráží kyselost jeho zvětralého prostředí..
Vlastnosti
Fyzický vzhled
Bílá pevná látka, která může mít různé formáty: zrnitý nebo práškový a amorfního vzhledu.
Molární hmotnost
78,00 g / mol
Hustota
2,42 g / ml
Bod tání
300 ° C Nemá žádný bod varu, protože hydroxid ztrácí vodu, aby se přeměnil na oxid hlinitý nebo oxid hlinitý, AldvaNEBO3.
Rozpustnost ve vodě
1 10-4 g / 100 ml. Jeho rozpustnost se však zvyšuje s přídavkem kyselin (H3NEBO+) nebo zásady (OH.)-).
Produkt rozpustnosti
K.sp = 3 10-34
Tato velmi malá hodnota znamená, že se ve vodě rozpustí jen nepatrná část:
Al (OH)3(s) <=> Do3+(aq) + 3OH-(ac)
A ve skutečnosti tato zanedbatelná rozpustnost z něj činí dobrý neutralizátor kyselosti, protože příliš nezalkalizuje žaludeční prostředí, protože neuvolňuje téměř OH ionty.-.
Amfoterismus
El Al (OH)3 vyznačuje se svým amfoterním charakterem; to znamená, že může reagovat nebo se chovat, jako by to byla kyselina nebo báze.
Například reaguje s ionty H.3NEBO+ (pokud je médium vodné) za vzniku komplexního vodného roztoku [Al (OHdva)6]3+; který je zase hydrolyzován, aby okyselil médium, proto Al3+ kyselý iont:
Al (OH)3(s) + 3H3NEBO+(ac) => [Al (OHdva)6]3+(ac)
[Al (OHdva)6]3+(ac) + HdvaO (l) <=> [Al (OHdva)5(ACH)]dva+(ac) + H3NEBO+(ac)
Když se to stane, říká se, že Al (OH)3 chová se jako základ, protože reaguje s H3NEBO+. Na druhou stranu může reagovat s OH-, chovat se jako kyselina:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
V této reakci bílá sraženina Al (OH)3 rozpouští se v přebytku iontů OH-; skutečnost, že se to nestává stejně s jinými hydroxidy, jako je hořčík, Mg (OH)dva.
El Al (OH)4-, hlinitanový iont, lze vhodněji vyjádřit jako: [Al (OHdva)dva(ACH)4]-, zvýraznění koordinačního čísla 6 pro Al kation3+ (osmistěn).
Tento iont může pokračovat v reakci s více OH- do dokončení koordinačního osmistěnu: [Al (OH)6]3-, nazývaný hexahydroxoaluminátový ion.
Nomenklatura
Název „hydroxid hlinitý“, s nímž se na tuto sloučeninu více odkazuje, odpovídá názvu, který se řídí nomenklaturou zásob. (III) je na konci vynechán, protože oxidační stav hliníku je +3 ve všech jeho sloučeninách.
Další dva možné názvy odkazující na Al (OH)3 Jsou to: trihydroxid hlinitý podle systematické nomenklatury a použití předpony řeckého čitatele; a hydroxid hlinitý, končící příponou -ico pro jediný oxidační stav.
Ačkoli v chemickém poli je nomenklatura Al (OH)3 nepředstavuje žádnou výzvu nebo zmatek, mimo to má tendenci se mísit s nejasnostmi.
Například minerál gibbsit je jedním z přírodních polymorfů Al (OH)3, které také pojmenovávají jako γ-Al (OH)3 nebo α-Al (OH)3. Α-Al (OH)3 může také odpovídat minerálu bayerit nebo β-Al (OH)3, podle krystalografické nomenklatury. Mezitím se polymorfy nordstrandit a doyleit obvykle označují jednoduše jako Al (OH)3.
Následující seznam jasně shrnuje to, co bylo právě vysvětleno:
-Gibbsit: (γ nebo α) -Al (OH)3
-Bayerit: (α nebo β) -Al (OH)3
-Nordstrandite: Al (OH)3
-Doyleit: Al (OH)3
Aplikace
Surovina
Okamžité použití hydroxidu hlinitého je jako surovina pro výrobu oxidu hlinitého nebo jiných anorganických nebo organických sloučenin hliníku; například: AlCl3, Ne3)3, AlF3 nebo NaAl (OH)4.
Katalytické podpěry
Nanočástice Al (OH)3 mohou působit jako katalytické nosiče; to znamená, že se k nim připojí katalyzátor, aby zůstali fixováni na svém povrchu, kde se urychlují chemické reakce.
Interkalační sloučeniny
V oddíle o strukturách bylo vysvětleno, že Al (OH)3 Skládá se z vrstev nebo listů A a B spojených k definování krystalu. Uvnitř jsou malé oktaedrické prostory nebo díry, které mohou být obsazeny jinými ionty, kovovými nebo organickými nebo neutrálními molekulami..
Když jsou syntetizovány krystaly Al (OH)3 S těmito strukturálními úpravami se říká, že se připravuje interkalační sloučenina; to znamená, že vkládají nebo vkládají chemické látky mezi listy A a B. Přitom vznikají nové materiály vyrobené z tohoto hydroxidu.
Zpomalovač ohně
El Al (OH)3 je to dobrý retardér hoření, který najde uplatnění jako výplňový materiál pro mnoho polymerních matric. Je to proto, že absorbuje teplo a uvolňuje vodní páru, stejně jako to dělá Mg (OH).dva nebo brucita.
Léčivý
El Al (OH)3 Je to také neutralizátor kyselosti reagující s HCl v žaludečních sekrecích; opět, podobně jako Mg (OH)dva magnéziové mléko.
Oba hydroxidy lze ve skutečnosti smíchat s různými antacidy, které se používají ke zmírnění příznaků lidí trpících gastritidou nebo žaludečními vředy..
Adsorbent
Při zahřátí pod teplotu tání se hydroxid hlinitý transformuje na aktivní oxid hlinitý (stejně jako aktivní uhlí). Tato pevná látka se používá jako adsorbent pro nežádoucí molekuly, ať už jde o barviva, nečistoty nebo znečišťující plyny..
Rizika
Rizika, která může hydroxid hlinitý představovat, nejsou způsobena pevnou látkou, ale léčivem. Pro jeho skladování nepotřebuje žádný protokol ani předpisy, protože nereaguje energicky s oxidačními činidly a není hořlavý..
Při požití v antacidách dostupných v lékárnách se mohou objevit nežádoucí vedlejší účinky, jako je zácpa a inhibice fosfátů ve střevech. Podobně, a ačkoli neexistují žádné studie, které by to dokázaly, byla spojována s neurologickými poruchami, jako je Alzheimerova choroba.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid hlinitý. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Hydroxid hlinitý. Databáze PubChem. CID = 10176082. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Hydroxid hlinitý: vzorec a vedlejší účinky. Studie. Obnoveno z: study.com
- Robert Schoen a Charles E. Roberson. (1970). Struktury hydroxidu hlinitého a geochemické implikace. Americký mineralog, svazek 55.
- Vitaly P. Isupov a spol. (2000). Syntéza, struktura, vlastnosti a aplikace interkalačních sloučenin hydroxidu hlinitého. Chemistry for Sustainable Development 8,121-127.
- Drogy. (24. března 2019). Hydroxid hlinitý vedlejší účinky. Obnoveno z: drugs.com



Zatím žádné komentáře