
Struktura hydroxidu vápenatého (Ca (OH) 2), vlastnosti, výroba, použití

The hydroxid vápenatý je anorganická sloučenina, jejíž chemický vzorec je Ca (OH)dva. Je to bílý prášek, který se používá již tisíce let a za tu dobu si vysloužil několik tradičních jmen nebo přezdívek; mezi nimi můžeme zmínit hašené, mrtvé, chemické, hydratované nebo jemné vápno.
V přírodě je k dispozici ve vzácném minerálu zvaném portlandit, stejné barvy. Z tohoto důvodu Ca (OH)dva Nezískává se přímo z tohoto minerálu, ale z tepelného zpracování, po kterém následuje hydratace vápence. Z toho se získá vápno, CaO, které se později uhasí nebo hydratuje za vzniku Ca (OH)dva.

Ca (OH)dva je to relativně slabá báze ve vodě, protože se v horké vodě těžko rozpouští; ale jeho rozpustnost se zvyšuje ve studené vodě, protože jeho hydratace je exotermická. Jeho zásaditost je však i nadále důvodem opatrnosti při manipulaci, protože může způsobit popáleniny jakékoli části těla..
Používá se jako regulátor pH pro různé materiály nebo potraviny a je také dobrým zdrojem vápníku, pokud jde o jeho hmotnost. Má uplatnění v papírenském průmyslu, při dezinfekci splašků, v depilačních výrobcích, v potravinách z kukuřičné mouky.
Nejdůležitějším použitím však bylo jako stavební materiál, protože vápno hydratuje, když je smícháno s dalšími přísadami v omítce nebo maltě. V těchto kalených směsích je Ca (OH)dva absorbuje oxid uhličitý ze vzduchu a konsoliduje krystaly písku společně s krystaly vytvořenými z uhličitanu vápenatého.
V současné době stále probíhá výzkum s cílem vyvinout lepší stavební materiály, které mají Ca (OH)dva přímo ve svém složení jako nanočástice.
Rejstřík článků
- 1 Struktura
- 1.1 Krystal a jeho ionty
- 1.2 Morfologie
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Bod tání
- 2.4 Hustota
- 2,5 pH
- 2.6 Rozpustnost ve vodě
- 2,7 Kps
- 2.8 Index lomu
- 2.9 Stabilita
- 3 Získání
- 4 použití
- 4.1 Ošetření potravin
- 4.2 Dezinfekční prostředek na odpadní vody
- 4.3 Papírenský průmysl
- 4.4 Absorbér plynu
- 4.5 Osobní péče
- 4.6 Stavební práce
- 5 Rizika a vedlejší účinky
- 6 Reference
Struktura
Krystal a jeho ionty
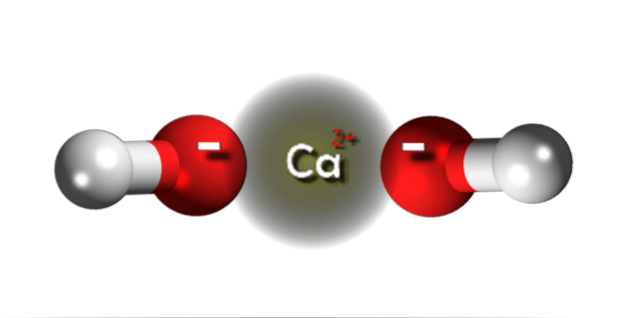
Na horním obrázku máme ionty, které tvoří hydroxid vápenatý. Stejný vzorec Ca (OH)dva poukazuje na to, že pro každý kationt Cadva+ existují dva OH anionty- které s ním interagují prostřednictvím elektrostatické přitažlivosti. Výsledkem je, že oba ionty nakonec vytvoří krystal s hexagonální strukturou.
V takových hexagonálních krystalech Ca (OH)dva ionty jsou velmi blízko u sebe, což dává vzhled polymerní struktury; i když formálně neexistuje kovalentní vazba Ca-O vzhledem k výraznému rozdílu v elektronegativitě mezi těmito dvěma prvky.
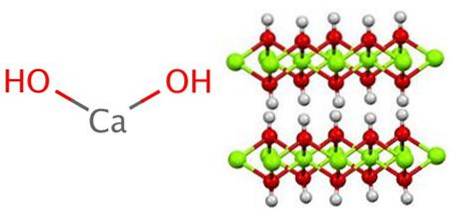
Struktura generuje octahedra CaO6, to je Cadva+ interaguje se šesti OH- (ACdva+-Ach-).
Řada těchto oktaedrů tvoří vrstvu krystalu, která může interagovat s jinou prostřednictvím vodíkových vazeb, které je udržují intermolekulárně soudržné; tato interakce však mizí při teplotě 580 ° C, když je Ca (OH) dehydratovándva do CaO.
Na straně vysokých tlaků není v tomto ohledu mnoho informací, ačkoli studie ukázaly, že při tlaku 6 GPa hexagonální krystal prochází přechodem z hexagonální do monoklinické fáze; as tím i deformace oktaedru CaO6 a jeho vrstvy.
Morfologie
Krystaly Ca (OH)dva Jsou šestihranné, ale to jim nebrání v přijetí jakékoli morfologie. Některé z těchto struktur (jako jsou prameny, vločky nebo kameny) jsou poréznější než jiné, robustní nebo ploché, což přímo ovlivňuje jejich konečné použití..
Není tedy totéž použít krystaly z minerálu portlandit, než je syntetizovat tak, aby sestávaly z nanočástic, kde je dodržováno několik přísných parametrů; jako je stupeň hydratace, použitá koncentrace CaO a doba, po kterou je krystal ponechán růst.
Vlastnosti
Fyzický vzhled
Bílá prášková pevná látka bez zápachu s hořkou chutí.
Molární hmotnost
74,093 g / mol
Bod tání
580 ° C Při této teplotě se rozkládá uvolňující voda, takže nikdy nedosáhne odpařování:
Ca (OH)dva => CaO + HdvaNEBO
Hustota
2211 g / cm3
pH
Nasycený vodný roztok téhož má pH 12,4 při 25 ° C.
Rozpustnost ve vodě
Rozpustnost Ca (OH)dva ve vodě klesá se zvyšováním teploty. Například při 0 ° C je jeho rozpustnost 1,89 g / l; zatímco při 20 ° C a 100 ° C je to 1,73 g / la 0,66 g / l.
To naznačuje termodynamický fakt: hydratace Ca (OH)dva je exotermická, takže při dodržení Le Chatelierova principu by rovnice byla:
Ca (OH)dva <=> ACdva+ + 2OH- + Q
Kde Q je uvolněné teplo. Čím je voda teplejší, tím více bude mít rovnováha tendenci doleva; tj. méně Ca (OH) se rozpustídva. Z tohoto důvodu se ve studené vodě rozpouští mnohem více než ve vroucí vodě..
Na druhé straně se uvedená rozpustnost zvyšuje, pokud se pH stane kyselým, v důsledku neutralizace OH iontů.- a posunutí přední rovnováhy doprava. Během tohoto procesu se uvolňuje ještě více tepla než v neutrální vodě. Kromě kyselých vodných roztoků obsahuje Ca (OH)dva je také rozpustný v glycerolu.
K.ps
5,5 10-6. Tato hodnota je považována za malou a odpovídá nízké rozpustnosti Ca (OH)dva ve vodě (stejná rovnováha jako výše).
Index lomu
1574
Stabilita
Ca (OH)dva zůstává stabilní, pokud není vystaven COdva ze vzduchu, protože ho absorbuje a tvoří uhličitan vápenatý, CaCO3. Proto začíná být kontaminován do pevné směsi krystalů Ca (OH)dva-Zloděj3, kde jsou CO anionty3dva- soutěžící s OH- komunikovat s Cadva+:
Ca (OH)dva + COdva => CaCO3 + HdvaNEBO
To je ve skutečnosti důvod, proč koncentrované roztoky Ca (OH)dva stanou se mléčnými, protože se objeví suspenze částic CaCO3.
Získávání
Ca (OH)dva Komerčně se získává reakcí vápna, CaO, se dvakrát až třikrát přebytkem vody:
CaO + HdvaO => Ca (OH)dva
V procesu však může nastat karbonizace Ca (OH)dva, jak je vysvětleno výše.
Jinými způsoby k jeho získání je použití rozpustných vápenatých solí, jako je CaCldva nebo Ca (NO3)dva, a zalkalizujte je NaOH, takže se vysráží Ca (OH)dva. Řídením parametrů, jako jsou objemy vody, teplota, pH, rozpouštědlo, stupeň karbonizace, doba zrání atd., Lze syntetizovat nanočástice s různými morfologiemi.
Může být také připraven výběrem přírodních a obnovitelných surovin nebo odpadu z průmyslu, který je bohatý na vápník a který při zahřátí a zpracování bude obsahovat popel z vápna; a odtud lze opět připravit Ca (OH)dva hydratací těchto popelů bez nutnosti plýtvání vápencem, CaCO3.
K tomuto účelu se například používá bageta z agáve, která přidává přidanou hodnotu odpadu z odvětví tequily..
Aplikace
Zpracování potravin

Hydroxid vápenatý je přítomen v mnoha potravinách v některých fázích přípravy. Například, okurky, jako jsou okurky, se ponoří do vodného roztoku, aby byly ostřejší, když jsou zabalené v octě. Je to proto, že bílkoviny na jeho povrchu absorbují vápník z média..
Totéž se děje u kukuřičných zrn před jejich transformací na mouku, protože pomáhá uvolňovat vitamin B.3 (niacin) a usnadňuje mletí. Vápník, který poskytuje, se také používá ke zvýšení nutriční hodnoty určitých šťáv.
Ca (OH)dva Může také nahradit prášek do pečiva v některých receptech na chléb a vyjasnit sladké roztoky získané z cukrové třtiny a řepy..
Kanalizační dezinfekční prostředek
Čiricí účinek Ca (OH)dva Je to proto, že působí jako flokulační činidlo; to znamená, že zvyšuje velikost suspendovaných částic, dokud se nevytvoří vločky, které se později usadí nebo je lze filtrovat.
Tato vlastnost byla použita k dezinfekci splašků, destabilizaci jejich koloidů, které jsou nepříjemné pro zrak (a vůni) diváků..
Papírenský průmysl
Ca (OH)dva používá se v procesu Kraft k regeneraci NaOH používaného k ošetření dřeva.
Absorbér plynu
Ca (OH)dva slouží k odstranění COdva uzavřených prostor nebo v prostředích, kde je jejich přítomnost kontraproduktivní.
Osobní péče
Ve formulacích pro depilační krémy Ca (OH)dva Je to mlčky zjištěno, protože jeho zásaditost pomáhá při oslabení keratinu ve vlasech, a proto je snazší je odstranit.
Konstrukce

Ca (OH)dva Je přítomen od nepaměti a integruje množství omítek a malty používaných při stavbě egyptských architektonických děl, jako jsou pyramidy; také budovy, mauzolea, stěny, schody, podlahy, podpěry a dokonce i přestavba zubního cementu.
Jeho posilující účinek je způsoben skutečností, že při „dýchání“ COdva, výsledné krystaly CaCO3 dokončit integraci písků a dalších složek těchto směsí do lepší míry.
Rizika a vedlejší účinky
Ca (OH)dva Ve srovnání s jinými hydroxidy to není silně bazická pevná látka, i když je to více než Mg (OH)dva. I přesto, že není reaktivní ani hořlavý, jeho bazicita je stále dostatečně agresivní, aby způsobila lehké popáleniny..
Proto s ním musí být zacházeno s respektem, protože je schopné dráždit oči, jazyk a plíce a také způsobit další neduhy, jako jsou: ztráta zraku, silná alkalizace krve, kožní vyrážky, zvracení a bolest v krku..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid vápenatý. Obnoveno z: en.wikipedia.org
- Chávez Guerrero a kol. (2016). Syntéza a charakterizace hydroxidu vápenatého získaného z agáve bagasy a studium jeho antibakteriální aktivity. Obnoveno z: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Krystalová struktura vysokotlaké fáze hydroxidu vápenatého, portlanditu: prášková in situ a rentgenová difrakční studie monokrystalů. Americký mineralog; 98 (8-9): 1421-1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (5. června 2019). Hydroxid vápenatý. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Aniruddha S. a kol. (2015). Syntéza hydroxidu vápenatého ve vodném prostředí. Americká keramická společnost. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12. dubna 2018). Jak se používá hydroxid vápenatý v potravinách a je to bezpečné? Obnoveno z: healthline.com
- Brian Clegg. (26. května 2015). Hydroxid vápenatý. Obnoveno z: chemistryworld.com


Zatím žádné komentáře