
Vlastnosti 1-oktenu, syntéza, použití, bezpečnostní list
The 1-okten Jedná se o alken, chemickou látku organické povahy, která se skládá z řetězce 8 lineárně uspořádaných uhlíků (alifatický uhlovodík), s dvojnou vazbou mezi prvním a druhým uhlíkem (poloha alfa), nazývaná 1-okten.
Dvojná vazba z něj činí nenasycený uhlovodík. Jeho chemický vzorec je C.8 H16 a jeho klasická nomenklatura je CH2 = CH-CHdva-CHdva-CHdva-CHdva-CHdva-CH3. Je to hořlavá sloučenina, se kterou je nutno zacházet opatrně a je nutné ji skladovat ve tmě, při pokojové teplotě a mimo dosah silných oxidantů a odtoků vody..
Syntéza této sloučeniny se provádí různými metodikami, mezi nejběžnější patří oligomerace ethylenu a Fischer-Tropschova syntéza. Je třeba poznamenat, že tyto postupy způsobují znečištění životního prostředí.
Proto Ávila-Zárraga a spolupracovníci popisují, že alkeny lze syntetizovat metodikou známou jako zelená chemie, která negeneruje zbytky, které poškozují životní prostředí..
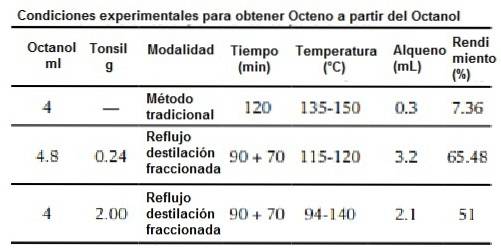
Rovněž zajišťují, že při použití metodiky čisté nebo zelené chemie se získá vyšší procento výtěžku, protože studie odhalila procento 7,3% pro tradiční metodu a 65% pro zelenou metodu..
Používá se jako surovina pro syntézu dalších organických sloučenin s významným využitím na průmyslové úrovni. Slouží také jako přísada do potravin (příchuť).
Rejstřík článků
- 1 Funkce
- 2 Syntéza
- 2.1 Oligomerizace ethylenu
- 2.2 Fischer-Tropschova syntéza
- 2.3 Syntéza tradiční metodou
- 2.4 Syntéza zelenou metodou
- 3 Použijte
- 4 Bezpečnostní list
- 5 Reference
Vlastnosti
1-okten je chemicky definován jako alken s 8 lineárními uhlíky, to znamená, že se jedná o alifatický uhlovodík. Je to také nenasycený uhlovodík, protože má ve své struktuře dvojnou vazbu..
Má molekulovou hmotnost 112,24 g / mol, hustotu 0,715 g / cm3, bod tání při -107 ° C, bod vzplanutí 8-10 ° C, bod samovznícení 256 ° C a bod varu při 121 ° C. Je to bezbarvá kapalina s charakteristickým zápachem, nerozpustná ve vodě a rozpustná v nepolárních rozpouštědlech..
Pára vydávaná tímto výrobkem je těžší než vzduch a kapalina je hustší než voda..
Syntéza
Existuje několik metod syntézy 1-oktenu, mezi nejznámější metodiky oligomerizace ethylenu a Fischer-Tropschova syntéza..
Oligomerizace ethylenu
Oligomerizaci ethylenu provádějí hlavně velké společnosti, jako jsou Shell a Chevron.
Tato technika používá homogenní katalyzátory na bázi přechodných kovů (organokovové katalyzátory) společně s kokatalyzátory, jako je alkyl-hliník.
Vzhledem k jeho vysokým nákladům a znečištění životního prostředí se však dnes hledají metodiky, které používají heterogenní katalyzátory, aby se minimalizovaly náklady a snížilo znečištění životního prostředí..
Fischer-Tropschova syntéza
Na druhou stranu syntéza Fischer-Tropsch je široce používána významnými společnostmi, jako je Sasol (jihoafrická ropná a plynárenská petrochemická společnost).
Technologie Fischer-Tropsch je založena na přeměně plynů (oxid uhelnatý a vodíky) na kapalné uhlovodíky.
Tato reakce vyžaduje zásah kovových katalyzátorů a specifické podmínky tlaku a vysoké teploty (150-300 ° C). Tato technika generuje tuny oxidu siřičitého (SOdva), oxidy dusíku (NOx) a oxid uhličitý (CO.)dva) denně jako odpad do životního prostředí (všechny znečišťující látky).
Jednou z nejnovějších a navrhovaných metodik, jak se vyhnout znečištění životního prostředí, je však dehydratace alkoholů za použití mandlí SSP jako katalyzátoru..
SSP mandle se skládá z oxidů kovů, například: (SiOdva, 73%; DodvaNEBO3, 9,1%; MgO, 2,9%; Nadva0, 1,1%; VíradvaNEBO3, 2,7%; K.dva0, 1,0%; CaO, 2,0% a TiOdva, 0,4%). Tato technika je zařazena do procesů nazývaných zelená chemie. To nahrazuje kyselinu sírovou a / nebo kyselinu fosforečnou.
Syntéza tradiční metodou
a) Mějte k dispozici zařízení pro přímý reflux, které je nezbytné pro provedení postupu.
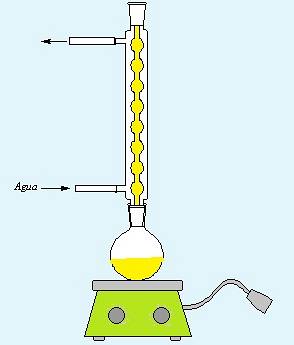
b) V baňce se nadávkuje 25 ml 98% kyseliny sírové nebo 85% kyseliny fosforečné 4 ml oktanolu.
c) Roztoky se smíchají pomocí grilu za míchání a zahřívání.
d) Po dobu 90 minut se zahřívá pod zpětným chladičem.
e) Povolte zařízení pro frakční destilaci.
f) Mírně zvyšte teplotu a sbírejte destilát do vhodné nádoby (Erlenmeyerova baňka), ochladí se v ledové lázni.
g) Odstraňte ze zdroje tepla, pokud v baňce zůstane malé množství zbytku kapaliny, nebo když je pozorována emise bílých par vznikajících při rozkladu reakční směsi..
h) Chlorid sodný se používá k nasycení destilátu, poté se dekantuje pomocí dělicí nálevky.
i) Při každé příležitosti proveďte 3 promytí 5 ml 5% hydrogenuhličitanu sodného.
j) Organická fáze se shromáždí v baňce a poté se ochladí v ledové lázni.
k) K sušení se potom použije bezvodý síran sodný. Získaná organická fáze následně odpovídá dekantaci alkenu (oktenu)..
l) Získaný černý kapalný zbytek je produktem rozkladu organické hmoty, musí se zpracovat zásaditými roztoky k neutralizaci pH.
Syntéza zelenou metodou
a) Povolte přímé odlivové zařízení.
b) V baňce se nadávkuje 4,8 ml oktanolu a 0,24 katalyzátoru (tonzil SSP).
c) Roztoky se smíchají pomocí grilu za míchání a zahřívání.
d) Po dobu 90 minut se zahřívá pod zpětným chladičem.
e) Připravte zařízení pro frakční destilaci.
f) Mírně zvyšte teplotu a sbírejte destilát do vhodné nádoby (Erlenmeyerova baňka), ochladí se v ledové lázni.
g) Odstraňte ze zdroje tepla, pokud uvnitř baňky a katalyzátoru zůstane trochu kapalného zbytku.
h) K sušení destilátu se používá síran sodný. Následně dekantujte pomocí dělicí nálevky. Získaná organická fáze odpovídá alkenu (oktenu).
Použití
1-okten se chová jako komonomer, to znamená, že je to monomer, který polymeruje s jinými monomery odlišnými od něj, i když má schopnost polymerovat sám se sebou.
Takto je tento produkt užitečný při výrobě dalších látek organické povahy, jako je polyethylen s vysokou a nízkou hustotou a povrchově aktivní látky..
Na druhou stranu je to důležitá sloučenina v řetězci reakcí nezbytných k získání lineárních C9 aldehydů. Ty se následně transformují oxidačními a hydrogenačními reakcemi na mastný alkohol (1-nonanol), který se používá jako změkčovadlo..
1-okten se používá jako ochucovadlo, a proto se přidává do některých potravin ve Spojených státech..
Bezpečnostní list
1-Octen je vysoce hořlavá látka, přičemž směs jejích par s jinými látkami může způsobit výbuch. Jako preventivní opatření je třeba se vyvarovat použití stlačeného vzduchu pro zacházení s touto látkou. Mělo by také být udržováno v prostředí bez plamenů a jisker. V případě požáru použijte k hašení plamenů suchý prášek, oxid uhličitý nebo pěnu.
S látkou by se mělo zacházet pomocí pláště, rukavic a ochranných brýlí a pod digestoří.
Vdechnutí produktu způsobuje ospalost a vertigo. Přímý kontakt způsobuje suchost pokožky. V případě kontaktu s pokožkou nebo sliznicemi se doporučuje postižené místo umýt velkým množstvím vody, v případě vdechnutí by měl pacient toto místo opustit a dýchat čistý vzduch. V případě požití velkého množství, vyhledejte lékařskou pomoc a nevyvolávejte zvracení.
Tento produkt by měl být skladován při pokojové teplotě, mimo silné oxidanty, chráněn před světlem a mimo odtok vody..
V případě rozlití je třeba jej shromáždit pomocí absorpčního materiálu, například písku. Tento produkt by neměl být likvidován do kanalizace, kanalizace nebo jiným způsobem, který ovlivňuje životní prostředí, protože je toxický pro vodní organismy..
Reference
- Ávila-Zárraga G, Cano S, Gavilán-García I. Zelená chemie, Získávání alkenů využívajících principy zelené chemie Chemické vzdělávání, 2010; 21 (2), 183-189. K dispozici na: scielo.org.
- Přispěvatelé na Wikipedii, '1-Octene', Wikipedia, The Free Encyclopedia,11. června 2019, 22:43 UTC, Dostupné na: org
- Moussa S. Oligomerizace ethylenu na heterogenních katalyzátorech ni-beta. Předběžná kinetická studie. Vysoká škola chemicko-technologická. Polytechnická univerzita ve Valencii. K dispozici na: /riunet.upv.es/
- Národní institut bezpečnosti a ochrany zdraví při práci. Vláda Španělska. 1-okten. K dispozici na: ilo.org/
- Společný kodexový výbor FAO / WHO pro potravinové normy pro potravinářské přídatné látky. Návrhy na doplnění a změny seznamu priorit potravinářských přídatných látek navržené k hodnocení JECFA. 45. setkání v Pekingu, Čína, 18. – 22. Března 2013. Dostupné na: fao.org/



Zatím žádné komentáře