
Struktura hydroxidu měďnatého, vlastnosti, názvosloví, použití

The hydroxid měďnatý o Hydroxid měďnatý je světle modrá nebo modrozelená krystalická anorganická pevná látka, jejíž chemický vzorec je Cu (OH)dva. Získává se jako objemná modrá sraženina přidáním alkalického hydroxidu k měďnatým roztokům (to znamená, že obsahují ionty Cudva+). Je to nestabilní sloučenina.
Pro zvýšení jeho stability se připravuje za přítomnosti amoniaku (NH3) nebo fosfáty Pokud se připravuje za přítomnosti amoniaku, vyrábí se materiál s dobrou stabilitou a velkými částicemi.

Když je připraven z fosforečnanu měďnatého, Cu3(PO4)dva, získá se materiál s jemnější velikostí částic a větším povrchem. Hydroxid měďnatý je široce používán jako fungicid a baktericid v zemědělství a při ošetřování dřeva, což prodlužuje jeho životnost..
Používá se také jako doplněk stravy pro zvířata. Používá se jako surovina k získávání dalších solí mědi (II) a při galvanickém pokovování povrchů.
Probíhají studie odhadující jeho potenciál v boji proti bakteriálním a plísňovým infekcím u lidí..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Další vlastnosti
- 4 použití
- 4.1 V zemědělství
- 4.2 Při konzervování dřeva
- 4.3 Při výrobě hedvábí
- 4.4 V průmyslu krmiv
- 4.5 Při výrobě jiných sloučenin mědi (II)
- 4.6 Jiná použití
- 4.7 Budoucí lékařské aplikace
- 5 Reference
Struktura
Hydroxid měďnatý obsahuje nekonečné řetězce iontů mědi (Cudva+) spojené můstky hydroxylových skupin (OH-).
Řetězy jsou tak zabalené, že 2 atomy kyslíku z ostatních řetězců jsou nad a pod každým atomem mědi, což předpokládá zkreslenou oktaedrickou konfiguraci, která je běžná ve většině sloučenin mědi (II)..
Ve své struktuře jsou čtyři atomy kyslíku ve vzdálenosti 1,93 A; dva atomy kyslíku jsou při 2,63 A; a vzdálenost Cu-Cu je 2,95 A.
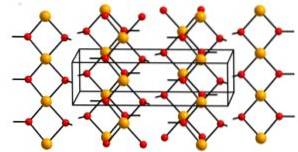
Nomenklatura
- Hydroxid měďnatý.
- Hydroxid měďnatý.
- Dihydroxid měďnatý.
Vlastnosti
Fyzický stav
Krystalická pevná látka.
Molekulární váha
99,58 g / mol.
Bod tání
Rozkládá se před roztavením. Bod rozkladu 229 ° C.
Hustota
3,37 g / cm3
Rozpustnost
Je prakticky nerozpustný ve vodě: 2,9 mikrogramů / l při 25 ° C. Rychle rozpustný v kyselinách, v koncentrovaných alkalických roztocích a v hydroxidu amonném. Nerozpustný v organických rozpouštědlech. V horké vodě se rozkládá za vzniku oxidu měďnatého, který je stabilnější.
Další vlastnosti
Je snadno rozpustný v silných kyselinách a také v koncentrovaných roztocích alkalických hydroxidů, za vzniku tmavomodrých aniontů, pravděpodobně [Cun(ACH)2n + 2]dva-.
Jeho stabilita závisí na způsobu přípravy.
Může se rozložit za vzniku černého oxidu měďnatého (CuO), pokud zůstane v klidu několik dní nebo při zahřívání.
V přítomnosti přebytku zásady se rozkládá nad 50 ° C.
Aplikace
V zemědělství
Hydroxid měďnatý má široké použití jako fungicid a antibakteriální prostředek v zemědělských plodinách. Zde jsou nějaké příklady:
- Působí proti bakteriálním skvrnám (z Erwinia) na hlávkový salát, který se použije jako listové ošetření.
- Proti bakteriálním skvrnám (z Xanthomonas pruni) v broskvích, u nichž se používá spící a listové ošetření.
- Používá se proti listovým a stonkovým škůdcům borůvek prostřednictvím latentních aplikací.
- Proti hnilobě při skladování borůvek způsobené Monilinia oxycocci, latentní aplikací.
Pro použití v zemědělství se používá hydroxid měďnatý, který se kvůli malé velikosti částic připravuje v přítomnosti fosforečnanů..

Při ochraně dřeva
Dřevo je organické povahy a je citlivé na napadení hmyzem a mikroorganismy. Hydroxid měďnatý se používá jako biocid pro houby, které napadají dřevo.
Obvykle se používá ve spojení s kvartérní amoniovou sloučeninou (NH4+). Hydroxid měďnatý působí jako fungicid a kvartérní amonná sloučenina funguje jako insekticid..
Takto ošetřené dřevo odolává nebo odolává provozním podmínkám a dosahuje úrovně výkonu požadované uživatelem. Dřevo ošetřené těmito sloučeninami má však vysokou hladinu mědi a je velmi korozivní pro běžnou ocel, proto je vyžadován typ nerezové oceli, který vydrží zpracování ošetřeného dřeva..
Přes svou užitečnost je hydroxid měďnatý považován za mírně nebezpečný biocid.
Z tohoto důvodu existují obavy, že bude uvolňováno z ošetřeného dřeva do životního prostředí v množstvích, která by mohla být škodlivá pro mikroorganismy přirozeně se vyskytující ve vodách (řeky, jezera, mokřady a moře) nebo v půdě..
Při výrobě hedvábí
Od 19. století se k rozpouštění celulózy používají amoniakální roztoky hydroxidu měďnatého. Jedná se o jeden z prvních kroků k získání vlákna zvaného rayon pomocí technologie vyvinuté německým Bembergem..
Hydroxid měďnatý se rozpouští v roztoku amoniaku (NH3), tvořící komplexní sůl.
Rafinovaná krátká bavlněná vlákna se přidají k roztoku mědi amoniaku obsahujícímu hydroxid měďnatý jako vysráženou pevnou látku..
Bavlněná celulóza tvoří komplex s hydroxidem měďnatým amonným, který se rozpouští v roztoku.
Toto řešení je následně koagulováno při průchodu vytlačovacím zařízením..
Díky své vysoké ceně byla tato technologie viskózou již překonána. Technologie Bemberg se v současné době používá pouze v Japonsku.
V krmivářském průmyslu
Používá se jako stopa v krmivech pro zvířata, protože je jednou z látek požadovaných jako stopové prvky pro úplnou výživu zvířat.

Je to proto, že ve vyšších živých bytostech je měď základním prvkem vyžadovaným pro činnost různých enzymů obsahujících měď..
Například je obsažen v enzymu, který se podílí na produkci kolagenu, a v enzymu potřebném pro syntézu melaninu, mimo jiné.
Je to sloučenina obecně uznávaná jako bezpečná, pokud se přidává na úrovních odpovídajících správné stravovací praxi..

Při výrobě jiných sloučenin mědi (II)
Aktivní prekurzor při výrobě následujících sloučenin mědi (II): naftenát měďnatý, 2-ethylhexanoát měďnatý a mýdla mědi. V těchto případech se používá hydroxid měďnatý, který se syntetizuje v přítomnosti amoniaku..
Jiná použití
Používá se při stabilizaci nylonu v bateriových elektrodách; jako fixátor barev při barvení; jako pigment; v insekticidech; při ošetřování a barvení papíru; v katalyzátorech, jako katalyzátor při vulkanizaci polysulfidového kaučuku; jako antifoulingový pigment; a v elektrolýze, v galvanickém pokovování.
Budoucí lékařské aplikace
Hydroxid měďnatý je součástí sloučenin mědi, které jsou studovány ve formě nanočástic k eliminaci bakterií, jako jsou E-coli, K. pneumoniae, P. aeruginosa, Salmonella spp., mimo jiné způsobují nemoci u lidí.
Bylo také zjištěno, že nanočástice mědi mohou být účinné proti Candida albicans, houba, která je běžnou příčinou lidských patologií.
To naznačuje, že nanotechnologie mědi může hrát důležitou roli proti bakteriím a plísním, které způsobují infekce u lidí, a hydroxid měďnatý by mohl být v těchto oblastech velmi užitečný..
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Svazek 7. Čtvrté vydání. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. Svazek A7. VCH Verlagsgesellschaft mbH.
- Bailar, J. C.; Emeléus, HJ; Sir Ronald Nyholm a Trotman-Dickenson, A.F. (1973). Komplexní anorganická chemie. Svazek 3. Pergamon Press.
- Národní lékařská knihovna. (2019). Hydroxyde měďnatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Schiopu, N. a Tiruta-Barna, L. (2012). Prostředky na ochranu dřeva. In Toxicita stavebních materiálů. Kapitola 6. Obnoveno ze sciencedirect.com.
- Mordorski, B. a Friedman, A. (2017). Kovové nanočástice pro mikrobiální infekci. In Functionalized Nanomaterials for the Management of Microbial Infection. Kapitola 4. Obnoveno ze sciencedirect.com.
- Takashi Tsurumi. (1994). Roztočení řešení. V pokročilé technologii zvlákňování vláken. Kapitola 3. Obnoveno ze sciencedirect.com.


Zatím žádné komentáře