
Izomerismus
Co je to izomerismus?
Isomerismus je chemický jev charakterizovaný tím, že molekuly se stejným počtem atomů mají různé chemické nebo fyzikální vlastnosti. Vyskytuje se tedy v izomerech, což jsou zase molekuly, jejichž chemické vzorce jsou stejné, ale jejich struktury nebo prostorová uspořádání se od sebe podstatně liší..
Máme ústavní nebo strukturní izomerismus a prostorový izomerismus, který soustřeďuje velkou pozornost na stereochemii. Vývojový diagram na obrázku níže ukazuje, že izomery se dělí hlavně na dva právě zmíněné typy izomerismu: konstituční a stereoizomery..
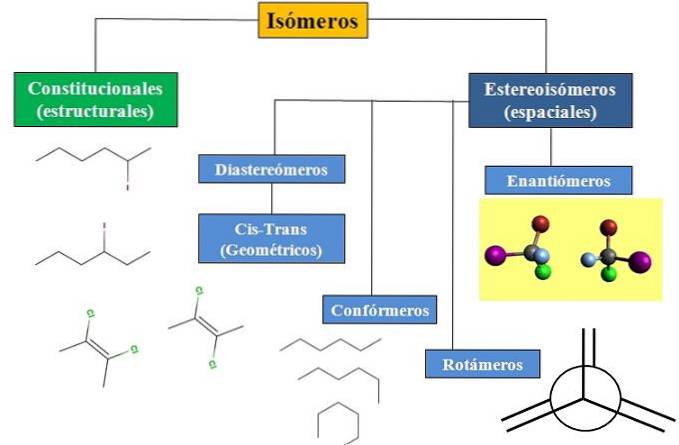
Všechny izomery pro určitou sloučeninu mají stejný chemický vzorec. Struktury, které tyto atomy mohou vytvářet, a jejich proporce jsou však pro každou molekulu nebo izomer jedinečné. I když je samotná struktura stejná, atomy nebo skupiny mohou zaujímat různé prostorové polohy..
Vývojový diagram ukazuje několik příkladů izomerů, které budou popsány v následujících částech..
Druhy izomerů
Ústavní
Konstituční nebo strukturní izomery jsou ty, které se liší uspořádáním molekulární páteře. To znamená, že jejich atomy nejsou spojeny stejným způsobem, takže příslušná struktura nebo funkční skupiny se mohou velmi lišit..
Například pro stejný chemický vzorec C7H10Nebo může existovat více molekul, které splňují tento počet atomů; všichni budou mít jeden atom kyslíku, ale strukturní uspořádání ostatních atomů bude pro každý izomer jedinečné.
A proto chemické a fyzikální vlastnosti všech konstitučních izomerů pro vzorec C.7H10Nebo se také budou od sebe velmi lišit.
Na druhou stranu mohou být konstituční izomery velmi jednoduché, liší se pouze v relativní poloze jednoho atomu nebo skupiny. V další části uvidíte příklad tohoto a výše uvedeného.
Stereoizomery
Stereoizomery jsou ty, které mají stejné strukturní uspořádání, ale liší se polohami a prostorovou orientací svých atomů nebo skupin..
Aby byla jejich existence možná, musí molekuly obsahovat stereogenní centra, nejznámější v organické chemii jsou asymetrické nebo chirální atomy uhlíku; tj. se čtyřmi různými substituenty.
Kromě asymetrických uhlíků musí uvažovaná molekula postrádat prvky symetrie. Jinak je nemožné, aby se z prostorového uspořádání stalo stereoizomerismus..
Enantiomery
Enantiomery jsou stereoizomery sestávající z nepřekrývajících se zrcadlových obrazů. Například pravá a levá ruka se nepřekrývají, stejně jako boty nebo rukavice. V další části se budeme zabývat klasickým příkladem enantiomerismu: bromchloro domethan: CBrClI.
Diastereomery
Na druhé straně diastereomery jsou také stereoizomery, ale nejsou to zrcadlové obrazy. To znamená, že umístění jednoho před druhým není odrazem sebe samých. Z nejznámějších diastereomerů máme cis-trans izomerismus, nazývaný také geometrický izomerismus, zvláště při aplikaci na alkeny.
Konformátoři
Konformátoři, i když jsou ve spektru stereoizomerismu, nejsou ve skutečnosti izomery. Jsou to prostorové konfigurace, které molekula v určitém okamžiku nebo energetickém stavu získá rotací několika svých vazeb. V další části uvidíme příklad konformátorů n-hexan.
Rotamery
Konečně máme rotamery, které se podobají konformerům v tom smyslu, že závisí na rotaci kovalentních vazeb..
Jednoduchá vazba mezi dvěma atomy uhlíku je však brána jako reference a jsou porovnány relativní polohy, ať už zastíněné nebo střídané, substituentů pro oba uhlíky. Později uvidíme příklad propylenových rotamerů.
Příklady izomerů
Hexan jod
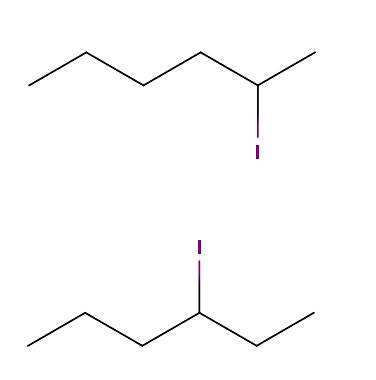
Nahoře máme dvě molekuly, jejichž chemické vzorce jsou C6H13I. V první máme 2-jodhexan, zatímco ve druhé 3-jodhexan. Jsou to konstituční izomery pozičního typu, protože kostra je stejná, s tím rozdílem, že poloha atomu jódu se liší od jednoho uhlíku k druhému..
C3H8NEBO
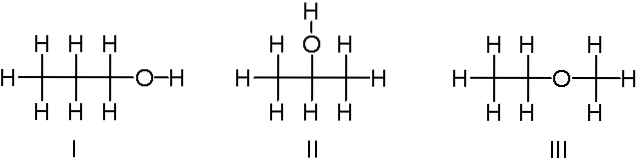
Nahoře máme další příklad konstitučních izomerů pro chemický vzorec C3H8O. Molekuly I a II jsou 1-propanol, respektive 2-propanol. Oba jsou alkoholy. Místo toho je molekula III o ethyl-methyl-etheru.
Mluvíme tedy o jiné funkční skupině. Všimněte si, že tři molekuly mají stejný počet atomů, ale jejich struktury jsou odlišné..
2,3-dichlor-2-buten
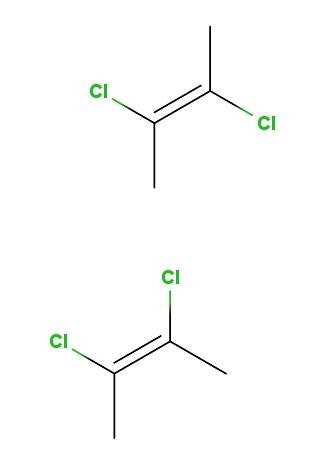
Nahoře máme trans-2,3-dichlor-2-butenový izomer a níže máme cis-2,3-dichlor-2-butenový izomer. V první jsou atomy chloru v opačných polohách vzhledem k dvojné vazbě, zatímco ve druhé leží na stejné straně dvojné vazby..
Páteř pro obě molekuly je stejná, liší se však v prostorové poloze atomů chloru; proto jsou to stereoizomery, a protože to nejsou zrcadlové obrazy, stávají se diastereomery.
3-fluor-2-methylcyklohexan
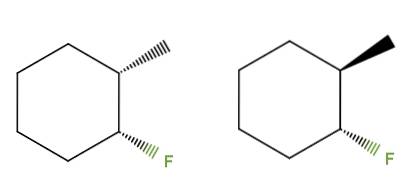
Tentokrát místo dvojné vazby máme cyklohexanový kruh pro sloučeninu 3-fluor-2-methylcyklohexan. V levém isomeru jsou skupiny CH3 a F jsou pod rovinou kruhu; zatímco v jednom napravo je CH3 je nahoře a F je dole.
Ten nalevo by tedy odpovídal cis izomeru a ten napravo by byl trans izomer. Jedná se tedy o diastereomery, protože opět nejde o zrcadlové obrazy.
Konformátoři n-hexan
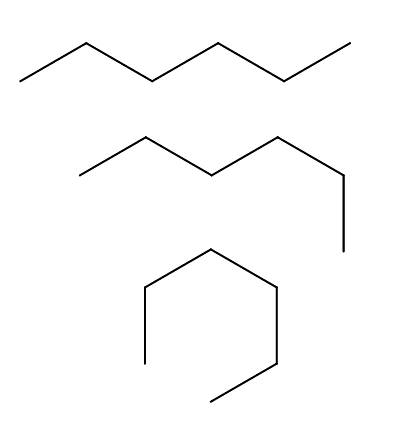
Máme více než tři konformátory n-hexan, které jsou výsledkem rotací a „ohybů“ uhlíkového řetězce v různých orientacích. Všechny odpovídají stejné molekule n-hexan s různými úrovněmi skládání, což bude záviset na prostředí a vnitřní energii každé molekuly.
3-brom-2-pentanol
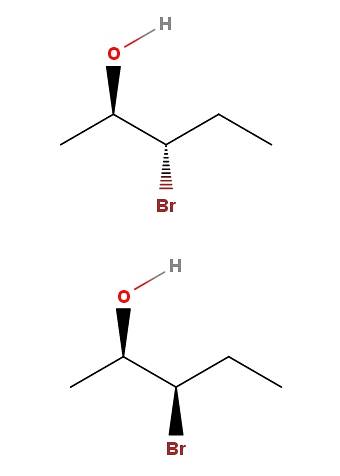
Ve 3-brom-2-pentanolu máme další příklad dvojice diastereomerů. Všimněte si, že v izomeru výše máme OH a Br směřující v opačných směrech roviny kostry; zatímco v dolním izomeru obě skupiny směřují ke směru čtenáře.
L-brom-3-chlor-5-ethylcyklohexan
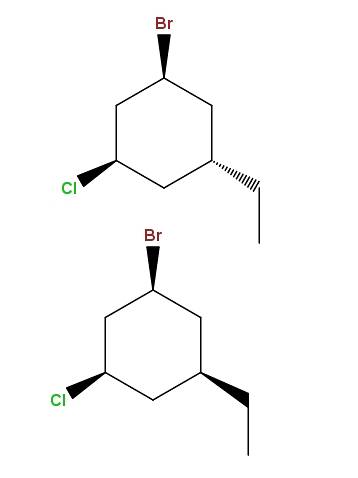
A opět tu máme další pár diastereomerů s tím rozdílem, že rozdíl nyní spočívá v prostorové poloze jedné skupiny: ethyl, -CHdvaCH3.
Tento typ izomerů má velmi specifický název: epimery, což jsou diastereomery, jejichž variace jsou pozorovány pouze v prostorové konfiguraci jednoho asymetrického uhlíku; v tomto případě ten, který je vázán na -CHdvaCH3.
Bromochlorooyodomethane
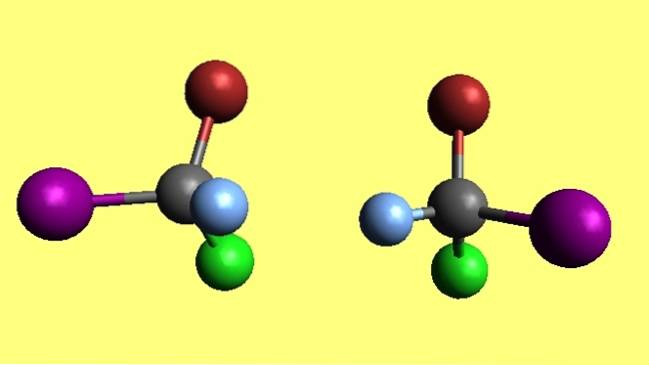
Všimněte si, že dvě molekuly bromchlorjodmethanu, CBrClI, jsou enantiomery, protože jedna je nepřeložitelným odrazem druhé. Bez ohledu na to, jak moc se snažíte, jeho čtyři atomy se nikdy neshodují. Říká se, že mají opačné prostorové konfigurace.
2-brom-4-ethylcyklohexan
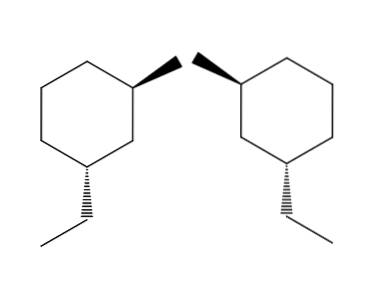
V příkladu 2-brom-4-ethylcyklohexanového páru molekul je enantiomerismus ještě patrnější. Pokud se pokusíme převrátit molekulu napravo, uvidíme tu skupinu -CHdvaCH3 nebude umístěn pod prstencem, ale nad ním.
Podobně CH3 Nebude ukazovat na prstenec, ale pod něj. Prostorové konfigurace jsou obrácené, jsou opačné. Toto je další z nejdůležitějších charakteristik enatiomerismu..
Propylenové rotamery
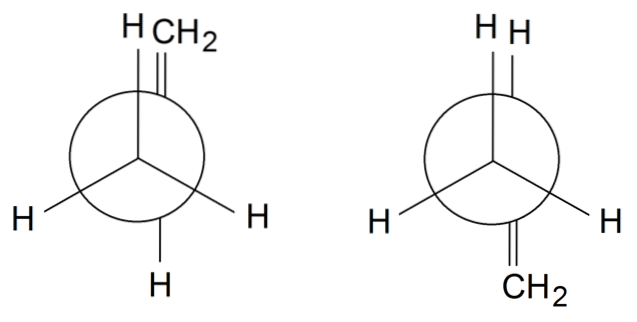
V propylenových rotamerech dokončíme rotaci jednoduché vazby mezi C.1 a C.dva: H3C-CH = CHdva. Skupina = CHdva je v zatměné poloze s jedním z Hs skupiny CH3 vpředu na rotametru vlevo. Mezitím = CHdva a H jsou ve střídavých polohách na pravém rotameru.
V závislosti na zatmění skupin nebo ne, budeme mít sterickou zábranu, která destabilizuje rotamer. Proto je rotamer vpravo stabilnější než ten vlevo..
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Morrison a Boyd. (1987). Organická chemie. (Páté vydání). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiomery, diastereomery, identické nebo konstituční izomery. Chemické kroky. Obnoveno z: chemistrysteps.com
- Wikipedia. (2020). Isomer. Obnoveno z: en.wikipedia.org
- Allison Soult. (13. srpna 2020). Izomery. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- James Ashenhurst. (2020). Stereochemie a chirality. Obnoveno z: masterorganicchemistry.com



Zatím žádné komentáře