
Joseph Thomson Biografie a příspěvky do vědy a chemie
Joseph John Thomson Byl vynikajícím chemikem pro různé příspěvky, jako například objev elektronu, jeho atomový model, objev izotopů nebo experiment s katodovým paprskem.
Narodil se v Cheetam Hill v okrese Manchester v Anglii 18. prosince 1856. Také známý jako „J.J.“ Thomson, studoval inženýrství na Owens College, nyní součást University of Manchester, a později matematiku na Cambridge.

V roce 1890 se J. J. Thomson oženil s Rose Elizabeth Pagetovou, dcerou lékaře sira Edwarda George Pageta, s nímž měl dvě děti: dívku jménem Joan Paget Thomson a chlapce George Pageta Thomsona..
Ten se stal slavným vědcem a v roce 1937 získal Nobelovu cenu za fyziku za práci s elektrony..
Od mladého věku se Thomson soustředil na studium struktury atomů, čímž mimo jiné objevil existenci elektronů a izotopů..
V roce 1906 obdržel Thomson Nobelovu cenu za fyziku, „jako uznání velké zásluhy jeho teoretického a experimentálního výzkumu vedení elektřiny plyny“, mimo jiné za řadu dalších prací. (1)
V roce 1908 byl povýšen do šlechtického stavu britskou korunou a působil jako čestný profesor fyziky v Cambridge a na Royal Institute v Londýně..
Zemřel 30. srpna 1940 ve věku 83 let ve městě Cambridge ve Velké Británii. Fyzik byl pohřben ve Westminsterském opatství poblíž hrobu sira Isaaca Newtona. (dva)
Rejstřík článků
- 1 Hlavní příspěvky Thomsona pro vědu
- 1.1 Objev elektronu
- 1.2 Thomsonův atomový model
- 1.3 Oddělení atomů
- 1.4 Objev izotopů
- 1.5 Katodové experimenty
- 1.6 Hmotnostní spektrometr
- 2 Thomsonovo dědictví
- 3 Vynikající díla
- 4 Odkazy
Thomsonovy hlavní příspěvky k vědě
Objev elektronu
V roce 1897 J.J. Thomson objevil novou částici lehčí než vodík, která byla pojmenována „elektron“.
Vodík byl považován za jednotku měření atomové hmotnosti. Do té doby byl atom nejmenším dělením hmoty.
V tomto smyslu Thomson jako první objevil záporně nabité korpuskulární subatomární částice.
Thomsonův atomový model
Thomsonův atomový model byla struktura, kterou anglický fyzik připisoval atomům. Pro vědce byly atomy sférou pozitivního náboje.
Tam byly uloženy elektrony záporného náboje, rovnoměrně rozložené na tomto oblaku kladného náboje, to znamená, že neutralizuje kladný náboj hmotnosti atomu..
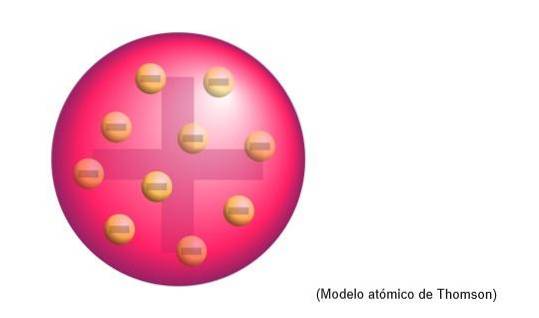
Tento nový model nahrazuje model vyvinutý Daltonem a bude později vyvrácen Rutherfordem, žákem Thomsona v Cavendish Laboratories v Cambridge..
Oddělení atomů
Thomson používal pozitivní nebo anodické paprsky k oddělení atomů různých hmot. Tato metoda mu umožnila vypočítat elektřinu přepravovanou každým atomem a počet molekul na centimetr krychlový..
Fyzik díky schopnosti rozdělit atomy různé hmotnosti a náboje objevil existenci izotopů. Také tímto způsobem svým studiem pozitivních paprsků vytvořil velký pokrok směrem k hmotnostní spektrometrii..
Objev izotopů
J.J. Thomson objevil, že neonové ionty mají různé hmotnosti, tj. Různé atomové hmotnosti. Takto Thomson ukázal, že neon má dva podtypy izotopů, neon-20 a neon-22..
Izotopy, studované dodnes, jsou atomy stejného prvku, ale jejich jádra mají různá hmotnostní čísla, protože jsou složena z různých množství neutronů v jejich středu..
Experimenty s katodovým paprskem
Katodové paprsky jsou proudy elektronů ve vakuových trubicích, tj. Skleněné trubice se dvěma elektrodami, jednou pozitivní a jednou negativní..
Když se záporná elektroda, neboli katoda, zahřívá, vyzařuje záření, které je směrováno směrem ke kladné elektrodě nebo anodě v přímce, pokud v této dráze není přítomné magnetické pole..
Pokud jsou skleněné stěny trubice pokryty fluorescenčním materiálem, dopad katod na tuto vrstvu způsobí projekci světla.
Thomson studoval chování katodových paprsků a dospěl k závěru, že paprsky cestují po přímce.
Také to, že tyto paprsky mohly být odkloněny od své dráhy přítomností magnetu, tj. Magnetického pole. Kromě toho paprsky mohly pohybovat lopatkami silou hmoty cirkulujících elektronů, což ukazuje, že elektrony měly hmotnost..
J.J. Thomson experimentoval s měněním plynu v katodové trubici, ale chování elektronů nezměnil. Také katodové paprsky ohřívaly předměty, které stály v cestě mezi elektrodami..
Na závěr Thomson ukázal, že katodové paprsky mají světelné, mechanické, chemické a tepelné účinky..
Katodové trubice a jejich světelné vlastnosti byly transcendentální pro následný vynález trubicové televize (CTR) a videokamer..
Hmotnostní spektrometr
J.J. Thomson vytvořil první přístup k Hmotnostní spektrometr. Tento nástroj umožnil vědci studovat vztah hmotnost / náboj katodových trubic a měřit, kolik se odchylují vlivem magnetického pole a množstvím energie, kterou přenášejí..
S tímto výzkumem dospěl k závěru, že katodové paprsky byly složeny ze záporně nabitých krvinek, které jsou uvnitř atomů, což postulovalo dělitelnost atomu a dalo vzniknout postavě elektronu..
Podobně pokroky v hmotnostní spektrometrii pokračovaly až do současnosti a vyvinuly se do různých metod k oddělení elektronů od atomů..
Thomson byl navíc první, kdo navrhl první vlnovod v roce 1893. Tento experiment spočíval v šíření elektromagnetických vln v kontrolované válcové dutině, které poprvé provedl v roce 1897 lord Rayleigh, další nositel Nobelovy ceny za fyziku..
Vlnovody by byly v budoucnu široce používány, dokonce i dnes s přenosem dat a optickými vlákny.
Thomsonovo dědictví
Thomson (Th) byl založen jako jednotka měření hmotnostního náboje v hmotnostní spektrometrii, kterou na počest Thomsona navrhli chemici Cooks a Rockwood..
Tato technika umožňuje určit distribuci molekul látky podle jejich hmotnosti a podle toho rozpoznat, které jsou přítomny ve vzorku hmoty..
Thomsonův vzorec (Th):
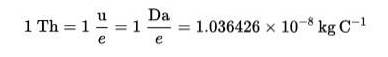
Vynikající díla
- Vypouštění elektřiny plyny, vedení elektřiny plyny (1900).
- Korpuskulární teorie hmoty, elektron v chemii a vzpomínky a úvahy (1907).
- Beyond the Electron (1928).
Reference
- Nobel Media AB (2014). J. Thomson - životopisný. Nobelprize.org. nobelprize.org.
- Thomson, Joseph J.., Vedení elektřiny prostřednictvím plynů. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Diskrétní kouzlo elementárních částic.
- Christen, Hans Rudolf, Základy obecné a anorganické chemie, svazek 1. Barcelona, Španělsko. Ediciones Reverté S.A., 1986.
- Arzani, Aurora Cortina, Obecná elementární chemie. Mexiko, Editorial Porrúa, 1967.
- R. G. Cooks, A. L. Rockwood. Rapid Commun. Hmotnostní spektrometr. 5, 93 (1991).

Zatím žádné komentáře