
Charles Lawovy vzorce a jednotky, experiment, cvičení
The zákon Charles nebo Guy-Lussac je ten, který umožňuje vyjádření jedné z vlastností plynného stavu: objem, který plyn zaujímá, je přímo úměrný teplotě při konstantním tlaku.
Tato proporcionalita je lineární pro všechny teplotní rozsahy, pokud je dotyčný plyn ideální; skutečné plyny se naproti tomu odchylují od lineárního trendu při teplotách blízkých rosnému bodu. To však neomezuje použití tohoto zákona pro nesčetné množství aplikací zahrnujících plyny..

Jednou z podstatných aplikací Charlesova zákona je ve vzduchových balónech. Další jednodušší balónky, například balónky přání, nazývané také čínské lucerny (horní obrázek), odhalují vztah mezi objemem a teplotou plynu při konstantním tlaku.
Proč při stálém tlaku? Protože pokud by se tlak zvyšoval, znamenalo by to, že nádoba, kde je umístěn plyn, je hermeticky uzavřena; a tím by se zvýšily srážky nebo nárazy plynných částic o vnitřní stěny uvedené nádoby (zákon Boyle-Mariotte).
Proto by nedošlo k žádné změně objemu obsazeného plynem a chyběl by Charlesův zákon. Na rozdíl od vzduchotěsného kontejneru představuje tkanina balónků přání mobilní bariéru, která se může rozpínat nebo smršťovat v závislosti na tlaku vyvíjeném plynem uvnitř..
Jak se však tkáň balónků rozpíná, vnitřní tlak plynu zůstává konstantní, protože se zvětšuje plocha, o kterou se jeho částice srazí. Čím vyšší je teplota plynu, tím vyšší je kinetická energie částic, a tím i počet srážek.
A jak se balónek znovu rozpíná, kolize o jeho vnitřní stěny zůstávají (v ideálním případě) konstantní..
Čím je plyn teplejší, tím větší je expanze balónu a tím vyšší bude jeho stoupání. Výsledek: červenavá (i když nebezpečná) světla zavěšená na obloze v prosincových nocích..
Rejstřík článků
- 1 Co je Charlesův zákon?
- 1.1 Prohlášení
- 1.2 Pracovní místa
- 1.3 Graf
- 2 Vzorce a měrné jednotky
- 2.1 Vzorce
- 2.2 Jednotky
- 3 Pokus prokázat zákon
- 3.1 Montáž
- 3.2 Vývoj
- 3.3 Balón s ledem v zimě
- 4 Vyřešená cvičení
- 4.1 Cvičení 1
- 4.2 Cvičení 2
- 4.3 Cvičení 3
- 5 Aplikace
- 5.1 Balónky přání
- 5.2 Vyskakovací nebo krůtí teploměry
- 5.3 Obnova tvaru pingpongových míčků
- 5.4 Příprava chleba
- 6 Reference
Co je Charlesův zákon?
Prohlášení
Tzv. Charlesův zákon nebo Gay-Lussacův zákon vysvětluje závislost, která existuje mezi objemem obsazeným plynem a hodnotou jeho absolutní teploty nebo Kelvinovy teploty..
Zákon lze konstatovat následovně: pokud tlak zůstává konstantní, znamená to, že „pro danou hmotnost plynu zvětší svůj objem přibližně o 1/273násobek svého objemu při 0 ° C, pro každý stupeň Celsia (1 ° C) zvýšit jeho teplotu ".
Pracovní místa
Výzkumnou práci, která stanovila zákon, zahájil v 80. letech 20. století Jacques Alexander Cesar Charles (1746-1823). Charles však nezveřejnil výsledky svého výzkumu..
Později se Johnu Daltonovi v roce 1801 podařilo experimentálně určit, že všechny jím studované plyny a páry expandují mezi dvěma určenými teplotami ve stejném objemovém množství. Tyto výsledky potvrdil Gay-Lussac v roce 1802.
Výzkumné práce Charlese, Daltona a Gay-Lussaca umožnily prokázat, že objem obsazený plynem a jeho absolutní teplota jsou přímo úměrné. Proto existuje lineární vztah mezi teplotou a objemem plynu.
Graf
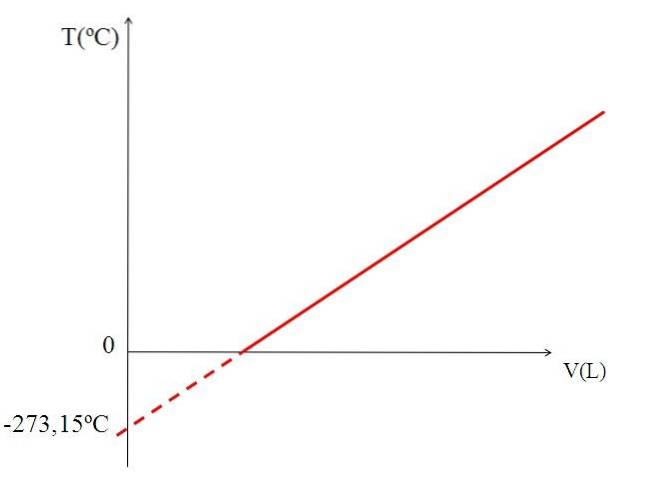
Grafy (horní obrázek) objemu plynu v závislosti na teplotě vytvoří přímku. Průsečík vedení s osou X, při teplotě 0 ° C, umožňuje získat objem plynu při 0 ° C.
Podobně by průsečík vedení s osou X poskytoval informace o teplotě, pro kterou by byl objem obsazený plynem nula „0“. Dalton tuto hodnotu odhadl na -266 ° C, což je blízko k hodnotě navržené Kelvinem pro absolutní nulu (0).
Kelvin navrhl teplotní stupnici, jejíž nula by měla být teplota, při které by dokonalý plyn měl nulový objem. Ale při těchto nízkých teplotách jsou plyny zkapalněné.
Proto není možné hovořit o objemech plynů jako takových, když zjistíme, že hodnota absolutní nuly by měla být -273,15 ° C.
Vzorce a měrné jednotky
Vzorce
Charlesův zákon ve své moderní verzi uvádí, že objem a teplota plynu jsou přímo úměrné.
Pak:
V / T = k
V = objem plynu. T = teplota Kelvina (K). k = konstanta proporcionality.
Pro svazek V1 a teplota T1
k = V1 / T1
Stejně tak pro svazek Vdva a teplota Tdva
k = Vdva / Tdva
Potom rovnicí dvou rovnic pro k máme
PROTI1 / T1 = Vdva / Tdva
Tento vzorec lze napsat následovně:
PROTI1 Tdva = Vdva T1
Řešení pro Vdva, dostanete vzorec:
PROTIdva = V1 Tdva / T1
Jednotky
Objem plynu lze vyjádřit v litrech nebo v kterékoli z jeho odvozených jednotek. Obdobně lze objem vyjádřit v metrech krychlových nebo v jakékoli odvozené jednotce. Teplota musí být vyjádřena v absolutní teplotě nebo v Kelvinově teplotě.
Pokud jsou tedy teploty plynu vyjádřeny ve stupních Celsia nebo stupnici Celsia, aby bylo možné s nimi provést výpočet, bylo by k teplotám třeba přidat částku 273,15 ° C, aby se dosáhlo absolutní teploty nebo kelvinu..
Pokud jsou teploty vyjádřeny ve stupních Fahrenheita, bylo by nutné k těmto teplotám přidat 459,67 ° R, aby byly uvedeny na absolutní teploty na Rankinově stupnici..
Další známý vzorec Charlesova zákona, který přímo souvisí s jeho tvrzením, je následující:
PROTIt = Vnebo (1 + t / 273)
Kde Vt je objem obsazený plynem při určité teplotě, vyjádřený v litrech, cm3, atd.; a Vnebo je objem obsazený plynem při 0 ° C. T je teplota, při které se měří objem, vyjádřená ve stupních Celsia (ºC).
A konečně 273 představuje hodnotu absolutní nuly na Kelvinově teplotní stupnici.
Pokuste se dokázat zákon
Montáž
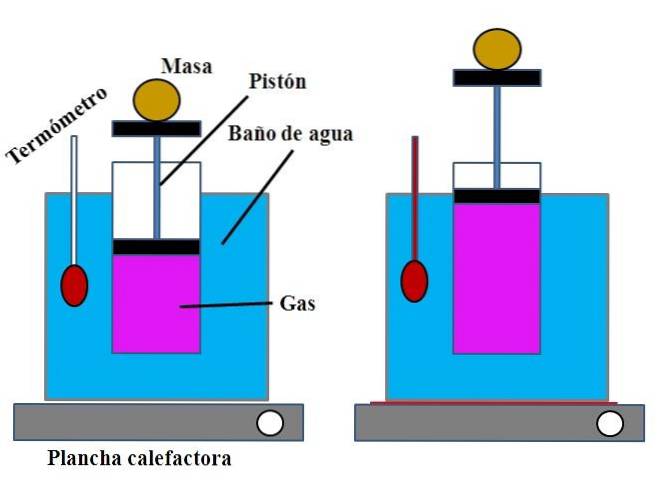
V nádobě s vodou, která plnila funkci vodní lázně, byl nahoře umístěn otevřený válec s pístem, který zapadal do vnitřní stěny válce (horní obrázek).
Tento píst (složený z pístu a dvou černých základen) se mohl pohybovat směrem k horní nebo dolní části válce v závislosti na objemu plynu, který obsahoval..
Vodní lázeň by mohla být ohřívána pomocí hořáku nebo topného zařízení, které dodávalo potřebné teplo pro zvýšení teploty lázně, a tím i teploty válce vybaveného pístem..
Stanovená hmotnost byla umístěna na píst, aby se zajistilo, že experiment byl prováděn při konstantním tlaku. Teplota lázně a válce byla měřena pomocí teploměru umístěného ve vodní lázni..
I když válec pravděpodobně neměl odstupňování pro vizualizaci objemu vzduchu, dalo by se to odhadnout měřením výšky dosažené hmotou umístěnou na pístu a povrchem základny válce..
Rozvíjející se
Objem válce se získá vynásobením povrchu jeho základny jeho výškou. Povrch základny válce lze získat pomocí vzorce: S = Pi x rdva.
Zatímco výška se získá měřením vzdálenosti od základny válce k části pístu, na které spočívá hmota.
Jak se teplota lázně zvyšovala teplem vytvářeným zapalovačem, bylo pozorováno, že píst stoupá uvnitř válce. Poté na teploměru odečetli teplotu ve vodní lázni, která odpovídala teplotě uvnitř válce..
Podobně měřili výšku hmoty nad pístem a byli schopni odhadnout objem vzduchu, který odpovídal naměřené teplotě. Tímto způsobem provedli několik měření teploty a odhady objemu vzduchu odpovídající každé z teplot..
Díky tomu bylo konečně možné zjistit, že objem, který plyn zaujímá, je přímo úměrný jeho teplotě. Tento závěr umožnil vysvětlit takzvaný Charlesův zákon.
Balón s ledem v zimě
Kromě předchozího experimentu existuje ještě jednodušší a kvalitativnější: u balónu s ledem v zimě..
Pokud by byl balón naplněný heliem v zimě umístěn do vytápěné místnosti, měl by balón určitý objem; Pokud by však byl později při nízké teplotě přesunut do vnější části domu, bylo by pozorováno, že se heliový balónek zmenšuje a zmenšuje jeho objem podle Charlesova zákona.
Vyřešená cvičení
Cvičení 1
Existuje plyn, který zaujímá objem 750 cm3 při 25 ° C: jaký bude objem, který tento plyn zabírá při 37 ° C, pokud bude tlak udržován konstantní?
Nejprve je nutné převést jednotky teploty na kelvin:
T1 ve stupních Kelvina = 25 ° C + 273,15 ° C = 298,15 K.
Tdva ve stupních Kelvina = 37 ° C + 273,15 ° C = 310,15 K.
Protože V1 a další proměnné řešíme pro Vdva a počítá se pomocí následující rovnice:
PROTIdva = V1 · (T.dva / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Cvičení 2
Jaká by byla teplota ve stupních Celsia, na kterou by se musely 3 litry plynu zahřát na 32 ° C, aby se jeho objem rozšířil na 3,2 litru?
Opět se stupně Celsia transformují na kelvin:
T1 = 32 ° C + 273,15 ° C = 305,15 K.
A stejně jako v předchozím cvičení je T vymazánodva místo Vdva, a počítá se níže:
Tdva = Vdva · (T.1 / V1)
= 3,2 l · (305,15 K / 3 l)
= 325,49 K.
Ale prohlášení požaduje stupně Celsia, takže jednotka T je změněnadva:
Tdva ve stupních Celsia = 325, 49 ° C (K) - 273,15 ° C (K)
= 52,34 ° C
Cvičení 3
Pokud plyn při 0 ° C zaujímá objem 50 cm3, Jaký objem zabírá při 45 ° C?
Podle původního vzorce Charlesova zákona:
PROTIt = Vnebo (1 + t / 273)
Pokračujeme k výpočtu Vt přímo, protože jsou k dispozici všechny proměnné:
PROTIt = 50 cm3 + 50 cm3 · (45 ° C / 273 ° C (K))
= 58,24 cm3
Na druhou stranu, pokud bude problém vyřešen pomocí strategie z příkladů 1 a 2, budeme mít:
PROTIdva = V1 · (T.dva / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Výsledek při použití obou postupů je stejný, protože jsou nakonec založeny na stejném principu Charlesova práva.
Aplikace
Přejeme balónky
Balónky přání (již zmíněné v úvodu) jsou vybaveny textilním materiálem impregnovaným hořlavou kapalinou.
Když je tento materiál zapálen, dojde ke zvýšení teploty vzduchu obsaženého v balónu, což podle Charlesova zákona způsobí zvýšení objemu plynu..
Proto se zvyšováním objemu vzduchu v balónu snižuje hustota vzduchu v něm, což je méně než hustota okolního vzduchu, a proto balón stoupá.
Vyskakovací nebo krůtí teploměry
Jak naznačuje jejich název, používají se při vaření krůt. Teploměr má vzduchem naplněnou nádobu uzavřenou víkem a je kalibrován takovým způsobem, že při dosažení optimální teploty vaření se víko zvedne a vydá zvuk..
Teploměr je umístěn uvnitř Turecka a jak se teplota uvnitř trouby zvyšuje, vzduch uvnitř teploměru se rozpíná a zvyšuje jeho objem. Poté, když objem vzduchu dosáhne určité hodnoty, zvedněte víko teploměru.
Obnovení tvaru pingpongových míčků
V závislosti na požadavcích na jejich použití jsou pingpongové koule lehké a jejich plastové stěny jsou tenké. To způsobí, že při nárazu raketami dojde k jejich deformacím.
Umístěním deformovaných koulí do horké vody se vzduch uvnitř ohřívá a rozpíná, což vede ke zvýšení objemu vzduchu. To také způsobí, že se stěna pingpongových koulí natáhne a umožní jim vrátit se do původního tvaru..
Výroba chleba
Kvasinky jsou zabudovány do pšeničné mouky používané k výrobě chleba a mají schopnost produkovat plynný oxid uhličitý..
Jak se teplota bochníků během vaření zvyšuje, zvyšuje se objem oxidu uhličitého. Z tohoto důvodu se chléb rozpíná, dokud nedosáhne požadovaného objemu..
Reference
- Clark J. (2013). Další zákony o plynu - Boyleův zákon a Charlesův zákon. Obnoveno z: chemguide.co.uk
- Staroscik Andrew. (2018). Charlesův zákon. Obnoveno z: scienceprimer.com
- Wikipedia. (2019). Charles Law. Obnoveno z: en.wikipedia.org
- Helmenstine, Todde. (27. prosince 2018). Jaký je vzorec pro Charlesův zákon? Obnoveno z: thoughtco.com
- N. De Leon. (s.f.). Zákony základních plynů: Charles Law. Poznámky k třídě C 101. Obnoveno z: iun.edu
- Briceño Gabriela. (2018). Charles Law. Obnoveno z: euston96.com
- Morris, J. G. (1974). Fyzikochemie pro biology. (dvadává edice). Redakční Reverté, S.A.


Zatím žádné komentáře