
Zákon zachování experimentů s hmotou a příklady

The zákon zachování hmoty nebo hmoty Je to ten, který stanoví, že při jakékoli chemické reakci není hmota ani vytvořena, ani zničena. Tento zákon je založen na skutečnosti, že atomy jsou nedělitelné částice v tomto typu reakce; zatímco v jaderných reakcích fragmenty atomů, což je důvod, proč chemické reakce nejsou brány v úvahu.
Pokud atomy nejsou zničeny, pak musí být při reakci prvku nebo sloučeniny udržován konstantní počet atomů před a po reakci; což se promítá do stálého množství hmoty mezi zúčastněnými reaktanty a produkty.
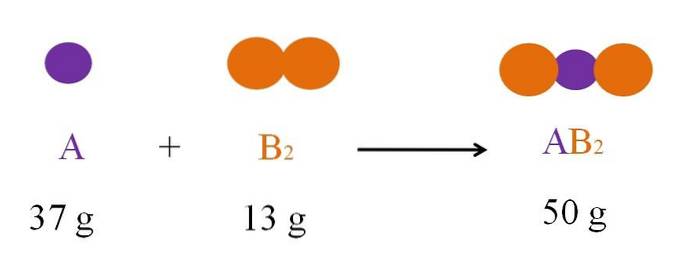
To platí vždy, pokud nedojde k úniku, který by způsobil ztrátu materiálu; ale pokud je reaktor hermeticky uzavřen, žádný atom „nezmizí“, a proto se nabitá hmotnost musí rovnat hmotnosti po reakci.
Pokud je produkt pevný, jeho hmotnost se bude rovnat součtu reaktantů podílejících se na jeho tvorbě. Totéž se děje u kapalných nebo plynných produktů, ale při měření jejich výsledných hmot je náchylnější k chybám..
Tento zákon se zrodil z experimentů v minulých stoletích a byl posílen příspěvky různých slavných chemiků, jako je Antoine Lavoisier..
Zvažte reakci mezi A a B.dva založit ABdva (horní obrázek). Podle zákona zachování hmoty hmotnost ABdva musí se rovnat součtu hmotností A a B.dva, resp. Pokud tedy 37 g A reaguje s 13 g Bdva, produkt ABdva musí vážit 50 g.
Proto v chemické rovnici hmotnost reakčních složek (A a Bdva) se musí vždy rovnat hmotnosti produktů (ABdva).
Příkladem velmi podobným právě popsanému je tvorba oxidů kovů, jako je rez nebo rez. Rez je těžší než železo (i když se to nemusí zdát), protože kov reagoval s množstvím kyslíku za vzniku oxidu.
Rejstřík článků
- 1 Jaký je zákon zachování hmoty nebo hmoty??
- 1.1 Lavoisierův příspěvek
- 2 Jak se tento zákon uplatňuje v chemické rovnici?
- 2.1 Základní principy
- 2.2 Chemická rovnice
- 3 Experimenty, které dokazují zákon
- 3.1 Spalování kovů
- 3.2 Uvolňování kyslíku
- 4 příklady (praktická cvičení)
- 4.1 Rozklad oxidu rtuťnatého
- 4.2 Spalování hořčíkové pásky
- 4.3 Hydroxid vápenatý
- 4.4 Oxid měďnatý
- 4.5 Tvorba chloridu sodného
- 5 Reference
Jaký je zákon zachování hmoty nebo hmoty??
Tento zákon stanoví, že při chemické reakci se hmotnost reaktantů rovná hmotnosti produktů. Zákon je vyjádřen frází „hmota není ani vytvořena, ani zničena, vše je transformováno“, jak ji přednesl Julius Von Mayer (1814-1878).
Zákon byl vyvinut nezávisle Michailem Lamanosovem v roce 1745 a Antoinem Lavoisierem v roce 1785. Ačkoli Lamanosovovy výzkumné práce na Zákonu o ochraně masa předcházely Lavoisierovu, v Evropě nebyly známy, protože byly napsány v ruštině..
Pokusy provedené v roce 1676 Robertem Boylem je vedly k tomu, že poukázali na to, že když byl materiál spalován v otevřené nádobě, hmotnost materiálu vzrostla; možná kvůli transformaci, kterou zažil samotný materiál.
Lavoiserovy experimenty se spalováním materiálů v nádobách s omezeným přívodem vzduchu ukázaly nárůst hmotnosti. Tento výsledek byl v souladu s výsledkem získaným Boyleem.
Lavoisierův příspěvek
Lavoisierův závěr však byl jiný. Myslel si, že během spalování bylo ze vzduchu extrahováno určité množství hmoty, což by vysvětlovalo nárůst hmotnosti, který byl pozorován u materiálů podrobených spalování..
Lavoiser si myslel, že hmotnost kovů zůstala během spalování konstantní a že pokles spalování v uzavřených kontejnerech nebyl způsoben poklesem uvolněné (nepoužívané koncepce), předpokládané podstaty související s výrobou tepla..
Lavoiser poukázal na to, že pozorovaný pokles byl způsoben spíše poklesem koncentrace plynů v uzavřených nádobách..
Jak se tento zákon uplatňuje v chemické rovnici?
Zákon zachování hmoty má ve stechiometrii transcendentální význam, který je definován jako výpočet kvantitativních vztahů mezi reaktanty a produkty přítomnými v chemické reakci..
Principy stechiometrie byly formulovány v roce 1792 Jeremíasem Benjaminem Richterem (1762 - 1807), který ji definoval jako vědu, která měří kvantitativní proporce nebo hmotnostní vztahy chemických prvků, které se účastní reakce..
Při chemické reakci dochází k modifikaci látek, které se na ní podílejí. Bylo pozorováno, že reaktanty nebo reaktanty jsou spotřebovány, aby vznikly produkty.
Během chemické reakce dochází k přerušení vazeb mezi atomy a také k vytváření nových vazeb; ale počet atomů zapojených do reakce zůstává nezměněn. Tomu se říká zákon zachování hmoty.
Základní principy
Tento zákon předpokládá dva základní principy:
-Celkový počet atomů každého typu je stejný v reaktantech (před reakcí) a v produktech (po reakci).
-Součet elektrických nábojů před a po reakci zůstává konstantní.
Je to proto, že počet subatomárních částic zůstává konstantní. Tyto částice jsou neutrony bez elektrického náboje, kladně nabité protony (+) a záporně nabité elektrony (-). Takže elektrický náboj se během reakce nemění.
Chemická rovnice
Z výše uvedeného vyplývá, že při představování chemické reakce prostřednictvím rovnice (jako je ta na hlavním obrázku) je třeba respektovat základní principy. Chemická rovnice používá symboly nebo reprezentace různých prvků nebo atomů a způsob, jakým jsou seskupeny do molekul před nebo po reakci.
Následující rovnice bude znovu použita jako příklad:
A + Bdva => ABdva
Dolní index je číslo, které je umístěno na pravé straně prvků (Bdva a ABdva) v dolní části, což udává počet atomů prvku přítomného v molekule. Toto číslo nelze změnit bez produkce nové molekuly, odlišné od původní..
Stechiometrický koeficient (1, v případě A a zbytku druhu) je číslo, které je umístěno na levé straně atomů nebo molekul, což indikuje jejich počet zapojený do reakce.
V chemické rovnici, pokud je reakce nevratná, je umístěna jedna šipka, která označuje směr reakce. Pokud je reakce reverzibilní, jsou v opačném směru dvě šipky. Vlevo od šipek jsou činidla nebo reaktanty (A a Bdva), zatímco na pravé straně jsou výrobky (ABdva).
Houpání
Vyvažování chemické rovnice je postup, který umožňuje vyrovnat počet atomů chemických prvků přítomných v reaktantech s atomy produktů.
Jinými slovy, počet atomů každého prvku musí být stejný na straně reaktantů (před šipkou) a na straně reakčních produktů (za šipkou).
Říká se, že když je reakce vyvážená, je respektován zákon hromadné akce.
Proto je nezbytné vyvážit počet atomů a elektrických nábojů na obou stranách šipky v chemické rovnici. Podobně musí být součet hmotností reaktantů roven součtu hmotností produktů.
V případě znázorněné rovnice je již vyvážená (stejný počet A a B na obou stranách šipky).
Experimenty, které dokazují zákon
Spalování kovů
Lavoiser, který sledoval spalování kovů, jako je olovo a cín, v uzavřených nádobách s omezeným přívodem vzduchu, si všiml, že kovy byly pokryty kalcinací; a dále, že hmotnost kovu v dané době zahřívání byla stejná jako počáteční.
Protože při spalování kovu je pozorován přírůstek hmotnosti, Lavoiser si myslel, že pozorovanou nadváhu lze vysvětlit určitou hmotou něčeho, co se během spalování odstraní ze vzduchu. Z tohoto důvodu zůstala hmotnost konstantní.
Tento závěr, který lze považovat za nezdravý vědecký základ, není takový, když vezmeme v úvahu znalosti, které měl Lavoiser o existenci kyslíku v době, kdy vyhlášen svůj zákon (1785).
Uvolňování kyslíku
Kyslík objevil Carl Willhelm Scheele v roce 1772. Později jej objevil nezávisle Joseph Priesley a zveřejnil výsledky svého výzkumu, tři roky předtím, než Scheele zveřejnil své výsledky na stejném plynu..
Priesley zahříval oxid rtuťnatý a sbíral plyn, který zvyšoval jas plamene. Navíc, když byly myši umístěny do nádoby s plynem, staly se aktivnějšími. Priesley nazval tento deloglogizovaný plyn.
Priesley hlásil svá pozorování Antoinovi Lavoiserovi (1775), který zopakoval své experimenty ukazující, že plyn byl nalezen ve vzduchu a ve vodě. Lavoiser poznal plyn jako nový prvek a pojmenoval jej kyslík.
Když Lavoisier použil jako argument pro vyjádření svého zákona, že nadměrná hmotnost pozorovaná při spalování kovů byla způsobena něčím, co bylo extrahováno ze vzduchu, myslel na kyslík, prvek, který se při spalování kombinuje s kovy.
Příklady (praktická cvičení)
Rozklad oxidu rtuťnatého
Pokud se zahřeje 232,6 oxidu rtuťnatého (HgO), rozloží se na rtuť (Hg) a molekulární kyslík (Odva). Na základě zákona zachování hmotnosti a atomových hmotností: (Hg = 206,6 g / mol) a (O = 16 g / mol), uveďte hmotnost Hg a Odva který se formuje.
HgO => Hg + Odva
232,6 g 206,6 g 32 g
Výpočty jsou velmi jednoduché, protože se právě rozkládá přesně jeden mol HgO.
Spalování hořčíkového pásu

1,2 g hořečnatého pásu byl spálen v uzavřené nádobě obsahující 4 g kyslíku. Po reakci zůstalo 3,2 g nezreagovaného kyslíku. Kolik oxidu hořečnatého bylo vytvořeno?
První věc, kterou je třeba vypočítat, je množství kyslíku, které reagovalo. To lze snadno vypočítat pomocí odečtení:
Mše O.dva která reagovala = počáteční hmotnost Odva - konečná hmotnost Odva
(4 - 3,2) g O.dva
0,8 g O.dva
Na základě zákona zachování hmotnosti lze vypočítat hmotnost vytvořeného MgO.
Hmotnost MgO = hmotnost Mg + hmotnost O
1,2 g + 0,8 g
2,0 g MgO
Hydroxid vápenatý
Hmota 14 g oxidu vápenatého (CaO) reagovala s 3,6 g vody (HdvaO), který byl při reakci zcela spotřebován za vzniku 14,8 g hydroxidu vápenatého, Ca (OH)dva:
Kolik oxidu vápenatého reagovalo za vzniku hydroxidu vápenatého?
Kolik oxidu vápenatého zbylo?
Reakci lze popsat následující rovnicí:
CaO + HdvaO => Ca (OH)dva
Rovnice je vyvážená. Proto je v souladu se zákonem zachování hmoty.
Hmotnost CaO zapojeného do reakce = hmotnost Ca (OH)dva - hmotnost HdvaNEBO
14,8 g - 3,6 g
11,2 g CaO
Proto se CaO, který nereagoval (ten, který zbyl), vypočítá odečtením:
Hmotnost přebytku CaO = hmotnost přítomná v reakci - hmotnost, která se zúčastnila reakce.
14 g CaO - 11,2 g CaO
2,8 g CaO
Oxid měďnatý
Kolik oxidu měďnatého (CuO) vznikne, když 11 g mědi (Cu) zcela reaguje s kyslíkem (Odva)? Kolik kyslíku je potřeba při reakci?
Prvním krokem je vyvážení rovnice. Vyvážená rovnice je následující:
2Cu + Odva => 2 CuO
Rovnice je vyvážená, takže je v souladu se zákonem zachování hmoty.
Atomová hmotnost Cu je 63,5 g / mol a molekulová hmotnost CuO je 79,5 g / mol..
Je nutné určit, kolik CuO vzniká z úplné oxidace 11 g Cu:
CuO hmotnost = (11 g Cu) ∙ (1 mol Cu / 63,5 g Cu) ∙ (2 mol CuO / 2 mol Cu) ∙ (79,5 g CuO / mol CuO)
Hmotnost vytvořeného CuO = 13,77 g
Rozdíl v hmotnostech mezi CuO a Cu proto udává množství kyslíku zapojeného do reakce:
Hmotnost kyslíku = 13,77 g - 11 g
1,77 g O.dva
Tvorba chloridu sodného
Množství chloru (Cldva2,47 g reagovalo s dostatečným množstvím sodíku (Na) a vzniklo 3,82 g chloridu sodného (NaCl). Kolik Na reagovalo?
Vyvážená rovnice:
2Na + Cldva => 2NaCl
Podle zákona zachování hmoty:
Hmotnost Na = hmotnost NaCl - hmotnost Cldva
3,82 g - 2,47 g
1,35 g Na
Reference
- Flores, J. Química (2002). Redakční Santillana.
- Wikipedia. (2018). Zákon zachování hmoty. Obnoveno z: es.wikipedia.org
- Národní polytechnický institut. (s.f.). Zákon zachování hmoty. CGFIE. Obnoveno z: aev.cgfie.ipn.mx
- Helmenstine, Anne Marie, Ph.D. (18. ledna 2019). Zákon zachování mše. Obnoveno z: thoughtco.com
- Shrestha B. (18. listopadu 2018). Zákon zachování hmoty. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org


Zatím žádné komentáře