
Ritchter-Wenzel právní příběhy, prohlášení a příklady

The Ritchter-Wenzelův zákon nebo vzájemných proporcí je takový, který stanoví, že hmotnostní proporce mezi dvěma sloučeninami umožňují určit poměr třetí sloučeniny. Je to jeden ze zákonů stechiometrie spolu s Lavoisierovým zákonem (zákon zachování hmoty); Proustův zákon (zákon určitých rozměrů); a Daltonův zákon (zákon několika rozměrů).
Ritcher vysvětlil svůj zákon v roce 1792 v knize, která definuje základy stechiometrie, na základě výzkumných prací Carla F. Wenzela, který v roce 1777 publikoval první tabulku ekvivalence pro kyseliny a zásady..
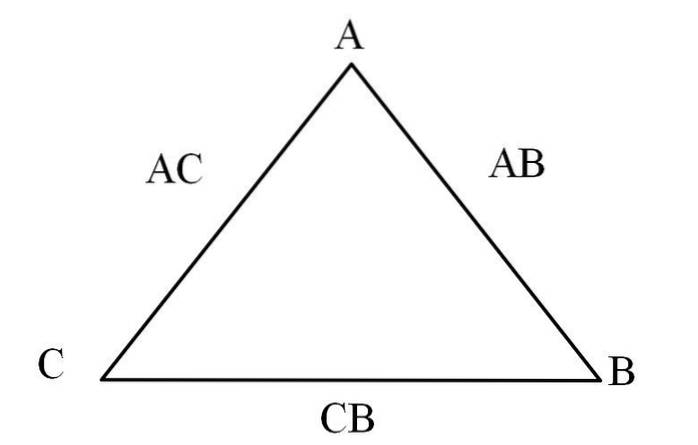
Jednoduchý způsob, jak si to představit, je prostřednictvím „trojúhelníku vzájemnosti“ (obrázek výše). Pokud znáte množství A, C a B, které se mísí za vzniku sloučenin AC a AB, můžete určit, kolik C a B se mísí nebo reaguje za vzniku sloučeniny CB.
Ve sloučeninách AC a AB je prvek A přítomen v obou, takže dělením jejich hmotnostních podílů zjistíme, kolik C reaguje s B.
Rejstřík článků
- 1 Historie a obecnost práva vzájemných rozměrů
- 2 Prohlášení a důsledky
- 3 příklady
- 3.1 Chlorid vápenatý
- 3.2 Oxidy síry
- 3.3 Sulfid a oxid železitý
- 4 Odkazy
Historie a obecnost zákona vzájemných rozměrů
Richter zjistil, že hmotnostní poměr sloučenin spotřebovaných při chemické reakci je vždy stejný.
V tomto ohledu Ritcher zjistil, že je třeba například 615 hmotnostních dílů hořčíku (MgO) k neutralizaci 1000 hmotnostních dílů kyseliny sírové.
V letech 1792 až 1794 Ritcher publikoval třídílný souhrn obsahující svou práci o právu určitých rozměrů. Abstrakt se zabýval stechiometrií a definoval ji jako umění chemických měření..
Poznamenává dále, že stechiometrie se zabývá zákony, podle nichž se látky spojují a tvoří sloučeniny. Richterova výzkumná práce však byla kritizována za matematické zacházení, které použil, a dokonce bylo zdůrazněno, že své výsledky upravil.
V roce 1802 Ernst Gottfried Fischer zveřejnil první tabulku chemických ekvivalentů, která používala kyselinu sírovou v hodnotě 1000; podobná hodnotě zjištěné Richterem pro neutralizaci kyseliny sírové magnézií.
Bylo však poznamenáno, že Richter zkonstruoval tabulku kombinačních hmotností, která udávala rychlost, jakou reagovala řada sloučenin. Například se uvádí, že 859 dílů NaOH neutralizuje 712 dílů HNO3.
Prohlášení a důsledky
Prohlášení zákona Richter-Wenzel je následující: masy dvou různých prvků, které jsou kombinovány se stejným množstvím třetího prvku, zachovávají stejný vztah jako masy těchto prvků, pokud jsou vzájemně kombinovány.
Tento zákon umožňoval stanovení ekvivalentní hmotnosti nebo hmotnostního ekvivalentu gramu jako množství prvku nebo sloučeniny, které bude reagovat s pevným množstvím referenční látky.
Richter nazval kombinační hmotnosti vzhledem k hmotnosti prvků, které se kombinovaly s každým gramem vodíku. Relativní kombinační hmotnosti Richtera odpovídají tomu, co je v současné době známé jako ekvivalentní hmotnost prvků nebo sloučenin.
V souladu s předchozím přístupem lze Richter-Wenzelův zákon konstatovat následovně:
Váhové kombinace různých prvků, které jsou kombinovány s danou váhou daného prvku, jsou relativními kombinovanými váhami těchto prvků, pokud jsou kombinovány navzájem, nebo násobky nebo dílčí násobky těchto kvantitativních vztahů.
Příklady
Chlorid vápenatý
V oxidu vápenatém (CaO) se 40 g vápníku kombinuje s 16 g kyslíku (O). Mezitím v oxidu chlorném (CldvaO), 71 g chloru se spojí se 16 g kyslíku. Jakou sloučeninu by vytvořil vápník, kdyby byl kombinován s chlorem?
Pomocí trojúhelníku vzájemnosti je kyslík společným prvkem pro tyto dvě sloučeniny. Nejprve se určí hmotnostní proporce dvou oxygenátů:
40 g Ca / 16 g O = 5 g Ca / 2 g O.
71 g Cl / 16 g O.
A teď dělení dvou hmotnostních podílů CaO a CldvaNebo budeme mít:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Zákon o hmotnostních podílech je splněn: 40 g vápníku reaguje se 71 g chloru.
Oxidy síry
Kyslík a síra reagují s mědí za vzniku oxidu měďnatého (CuO) a sulfidu měďnatého (CuS). Kolik síry by reagovalo s kyslíkem?
V oxidu měďnatém se 63,5 g mědi kombinuje se 16 g kyslíku. V sulfidu mědi se 63,5 g mědi váže na 32 g síry. Dělíme proporce hmoty, které máme:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
Hmotnostní poměr 2: 1 je násobkem 4 (63,5 / 16), což ukazuje, že Richterův zákon je pravdivý. S tímto podílem se získá SO, oxid uhelnatý (32 g síry reaguje se 16 g kyslíku).
Pokud tento poměr vydělíte dvěma, dostanete 1: 1. Opět je to nyní násobek 4 nebo 2, a proto jde o SOdva, oxid siřičitý (32 g síry reaguje s 32 g kyslíku).
Sulfid a oxid železa
Sulfid železa (FeS), ve kterém je 32 g síry kombinováno s 56 g železa, reaguje s oxidem železnatým (FeO), ve kterém je 16 g kyslíku kombinováno s 56 g železa. Tato položka slouží jako reference.
V reagujících sloučeninách FeS a FeO se síra (S) a kyslík (O) ve vztahu k železu (Fe) nacházejí v poměru 2: 1. V oxidu siřičitém (SO) se 32 g síry kombinuje se 16 g kyslíku, takže síra a kyslík jsou v poměru 2: 1..
To naznačuje, že je splněn zákon vzájemnosti nebo Richterův zákon.
Poměr mezi sírou a kyslíkem v oxidu siřičitém (2: 1) lze použít například k výpočtu toho, kolik kyslíku reaguje s 15 g síry.
g kyslíku = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Reference
- Foist L. (2019). Zákon vzájemného poměru: Definice a příklady. Studie. Obnoveno z: study.com
- Kybernetické úkoly. (2016, 9. února). Zákon vzájemných rozměrů nebo Richter-Wenzel. Obnoveno z: cibertareas.infol
- Wikipedia. (2018). Zákon vzájemných rozměrů. Obnoveno z: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter a zákon vzájemných rozměrů.-II, Annals of Science, 9: 4, 289-314, DOI: 10,1080 / 00033795300200233
- Shrestha B. (18. června 2015). Zákon vzájemných rozměrů. Chemistry Libretexts. Obnoveno z: chem.libretexts.org
- Předefinování znalostí. (29. července 2017). Zákon vzájemných rozměrů. Obnoveno z: hemantmore.org.in



Zatím žádné komentáře