
Methylová nebo methylová skupina
The methylová nebo methylová skupina je alkylový substituent, jehož chemický vzorec je CH3. Je to nejjednodušší ze všech uhlíkových substituentů v organické chemii, má jediný uhlík a tři vodíky; pochází z metanového plynu. Protože se může vázat pouze na jiný uhlík, jeho poloha označuje konec řetězce, jeho ukončení.
Na obrázku níže je jedno z mnoha reprezentací této skupiny. Křivky vpravo ukazují, že za H spojem3C- může být jakýkoli atom nebo substituent; alkyl, R, aromatický nebo aryl, Ar nebo heteroatom nebo funkční skupina, jako je OH nebo Cl.

Když je funkční skupinou připojenou k methylu OH, máme alkohol methanol, CH3ACH; a pokud je to Cl, pak budeme mít methylchlorid, CH3Cl. V organické nomenklatuře se označuje jednoduše jako „methyl“, kterému předchází číslo jeho polohy v nejdelším uhlíkovém řetězci.
Methylová skupina CH3 je snadno identifikovatelný při objasňování organických struktur, zejména díky uhlíkové 13 nukleární magnetické rezonanční spektroskopii (C NMR13). Z ní se po silných oxidacích získají skupiny kyselin COOH, což je syntetický způsob syntézy karboxylových kyselin.
Rejstřík článků
- 1 Prohlášení
- 2 Struktura
- 3 Vlastnosti
- 4 Reaktivita
- 4.1 Oxidace
- 4,2 ionty
- 4.3 Methylační reakce
- 5 Reference
Zastoupení
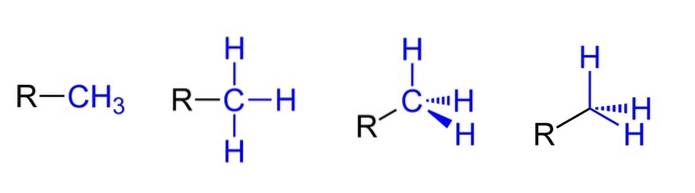
Nahoře máme čtyři možné reprezentace za předpokladu, že CH3 je spojen s alkylovým substituentem R. Všechny jsou ekvivalentní, ale při přechodu zleva doprava jsou patrné prostorové aspekty molekuly.
Například R-CH3 budí dojem, že je plochý a lineární. Znázornění, které následuje, ukazuje tři kovalentní vazby C-H, které umožňují identifikaci methylu v jakékoli Lewisově struktuře a vytvářejí falešný dojem, že jsou křížem..
Poté pokračováním doprava (předposlední) je pozorována sp hybridizace3 na uhlíku CH3 kvůli jeho čtyřboké geometrii. V posledním vyjádření není chemický symbol pro uhlík ani napsán, ale čtyřstěn je udržován, aby indikoval, které atomy H jsou před nebo za rovinou..
Ačkoli to není na obrázku, další velmi opakující se způsob, jak reprezentovat CH3 spočívá v jednoduchém umístění pomlčky (-) „nahý“. To je velmi užitečné při kreslení velkých uhlíkových koster..
Struktura

Horní obrázek je trojrozměrná reprezentace prvního. Lesklá černá koule odpovídá atomu uhlíku, zatímco bílé jsou atomy vodíku.
Uhlík má opět čtyřboký produkt prostředí své sp hybridizace3, a jako taková se jedná o relativně objemnou skupinu se stéricky bráněnými rotacemi vazeb C-R; to znamená, že se nemůže otáčet, protože bílé koule by interferovaly s elektronickými mračny sousedních atomů a cítily jejich odpor.
Avšak vazby CH mohou vibrovat, stejně jako vazby CH. Proto CH3 je skupina čtyřboké geometrie, kterou lze objasnit (určit, zjistit) spektroskopií infračerveným zářením (IR), stejně jako všechny funkční skupiny a uhlíkové vazby s heteroatomy.
Nejdůležitější je však jeho objasnění pomocí C-NMR.13. Díky této technice se určuje relativní množství methylových skupin, což umožňuje sestavení molekulární struktury..
Obecně platí, že čím více skupin CH3 mít molekulu, tím „nemotornější“ nebo neúčinnější budou její intermolekulární interakce; to znamená, čím nižší budou jejich teploty tání a varu. CH skupiny3, díky svým vodíkům „klouzají“ proti sobě, když se blíží nebo dotýkají.
Vlastnosti
Methylová skupina je charakterizována tím, že je v podstatě hydrofobní a nepolární.
Je to proto, že jejich C-H vazby nejsou příliš polární kvůli nízkému rozdílu mezi elektronegativitami uhlíku a vodíku; Kromě toho jeho čtyřboká a symetrická geometrie distribuuje své elektronové hustoty téměř homogenně, což přispívá ke zanedbatelnému dipólovému momentu..
Pokud není polarita, CH3 „Uteče“ z vody a chová se jako hydrofob. Pokud je tedy vidět v molekule, bude známo, že tento methylový konec nebude účinně interagovat s vodou nebo jiným polárním rozpouštědlem..
Další vlastnost CH3 je jeho relativní stabilita. Pokud atom, který je na něj navázán, neodstraní svou elektronovou hustotu, zůstává prakticky inertní vůči velmi silnému kyselému prostředí. Bude však vidět, že se může účastnit chemických reakcí, zejména s ohledem na jeho oxidaci nebo migraci (methylaci) na jinou molekulu.
Reaktivita
Oxidace
CH3 není osvobozen od rezivění. To znamená, že je náchylný k vytváření vazeb s kyslíkem, C-O, pokud reaguje se silnými oxidačními činidly. Jak oxiduje, transformuje se do různých funkčních skupin.
Například jeho první oxidace vede k methiolové (nebo hydroxymethylové) skupině, CHdvaOH, alkohol. Druhá je odvozena od formylové skupiny, CHO (HC = O), aldehydu. A třetí konečně umožňuje její přeměnu na karboxylovou skupinu, COOH, karboxylovou kyselinu.
Tato řada oxidací se používá k syntéze kyseliny benzoové (HOOC-C6H5) z toluenu (H.3DC6H5).
Ion
CH3 během mechanismu některých reakcí může získat okamžité elektrické náboje. Například při zahřívání methanolu ve velmi silném kyselém prostředí, při teoretické nepřítomnosti nukleofilů (hledajících kladné náboje), se methylový kation, CH3+, protože CH vazba je přerušena3-OH a OH opouští elektronový pár vazby.
Druh CH3+ je tak reaktivní, že byla stanovena pouze v plynné fázi, protože reaguje nebo zmizí při sebemenší přítomnosti nukleofilu.
Na druhou stranu CH3 lze také získat anion: methanid, CH3-, nejjednodušší karbanion ze všech. Stejně jako ch3+, jeho přítomnost je abnormální a vyskytuje se pouze za extrémních podmínek.
Methylační reakce
Při methylační reakci se přenese CH3 na molekulu bez produkce elektrických nábojů (CH3+ ani CH3-) v průběhu. Například methyljodid, CH3I, je dobré methylační činidlo a může nahradit O-H vazbu několika molekul O-CH3.
V organické syntéze to neznamená žádnou tragédii; ale ano, když to, co je methylováno v přebytku, jsou dusíkaté báze DNA.
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Rahul Gladwin. (23. listopadu 2018). Methylace. Encyklopedie Britannica. Obnoveno z: britannica.com
- Danielle Reid. (2019). Methylová skupina: struktura a vzorec. Studie. Obnoveno z: study.com
- Wikipedia. (2019). Methylová skupina. Obnoveno z: en.wikipedia.org


Zatím žádné komentáře