
Struktura myoglobinu, funkce, normální hodnoty
The myoglobin Jedná se o globulární intracelulární protein nacházející se v cytosolu buněk kosterního a srdečního svalu. Jeho základní funkcí je vytvářet kyslíkovou rezervu a podporovat intracelulární transport kyslíku..
John Kendrew a Max Perutz obdrželi v roce 1962 Nobelovu cenu za chemii za studium globulárních proteinů. Tito autoři objasnili trojrozměrnou strukturu myoglobinu a hemoglobinu. Historicky byl myoglobin jedním z prvních proteinů, ze kterých byla stanovena trojrozměrná struktura..
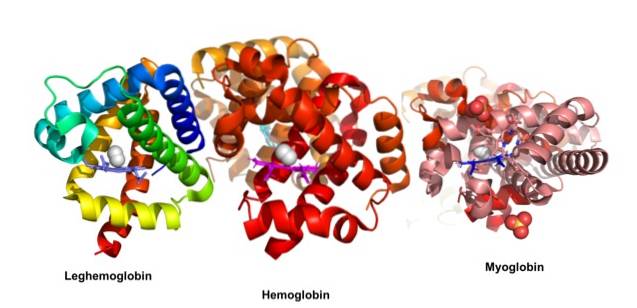
Globulární proteiny jsou kompaktní molekuly sférického tvaru; jsou rozpustné v cytosolu nebo v lipidové části buněčných membrán. Jsou zodpovědní za hlavní biologické účinky, na rozdíl od vláknitých proteinů, jejichž hlavní funkce jsou strukturální.
Myoglobin dodává čerstvému masu červenou barvu. K tomu dochází, když je myoglobin okysličován jako oxymyoglobin a železo, které jej tvoří, je ve formě železného železa: Mb-Fe2 + O2.
Když je maso vystaveno životnímu prostředí, nestabilní železné železo oxiduje a stává se železitým a za těchto podmínek se barva změní na hnědé tóny v důsledku tvorby methamyoglobinu (Mb-Fe3 + + O2 ● -).
Normálně jsou hladiny myoglobinu v krvi velmi malé, řádově v mikrogramech na litr (μg / l). Tyto hladiny se zvyšují, když dojde k destrukci svalu, jako je to u rhabdomyolýzy kosterního svalstva nebo u srdečního infarktu s destrukcí tkáně au některých myopatií..
Jeho přítomnost v moči je pozorována za určitých podmínek, při nichž je poškození tkáně velmi důležité. Jeho časná diagnostická hodnota pro infarkt je diskutabilní.
Rejstřík článků
- 1 Struktura myoglobinu
- 2 Funkce
- 2.1 Druhy svalových vláken a myoglobinu
- 3 Normální hodnoty
- 4 Odkazy
Struktura myoglobinu
Myoglobin má molekulovou hmotnost téměř 18 kDa včetně hemové skupiny. Skládá se ze čtyř spirálových segmentů spojených „ostrými zatáčkami“. Tyto myoglobinové šroubovice jsou pevně zabalené a zachovávají si svou strukturální integritu, i když je odstraněna skupina hemu..
Struktura globulárních proteinů, stejně jako všech buněčných proteinů, je hierarchická, takže struktura myoglobinu je také hierarchická. První úroveň je primární struktura tvořená lineární sekvencí aminokyselin a myoglobin je tvořen řetězcem 153 aminokyselin..
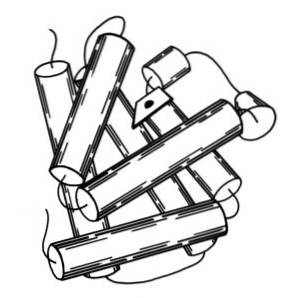
Sekundární struktura myoglobinu se skládá z konformace alfa helixů. Myoglobin obsahuje 8 alfa šroubovic vytvořených opakováním polypeptidových částí, které jsou spojeny krátkými segmenty neperiodického uspořádání..
Terciární struktura se skládá z trojrozměrné konformace s biologickou aktivitou. Nejdůležitějšími vlastnostmi této struktury jsou záhyby. Kvartérní struktura označuje sestavu dvou nebo více polypeptidových řetězců oddělených a spojených prostřednictvím nekovalentních vazeb nebo interakcí..
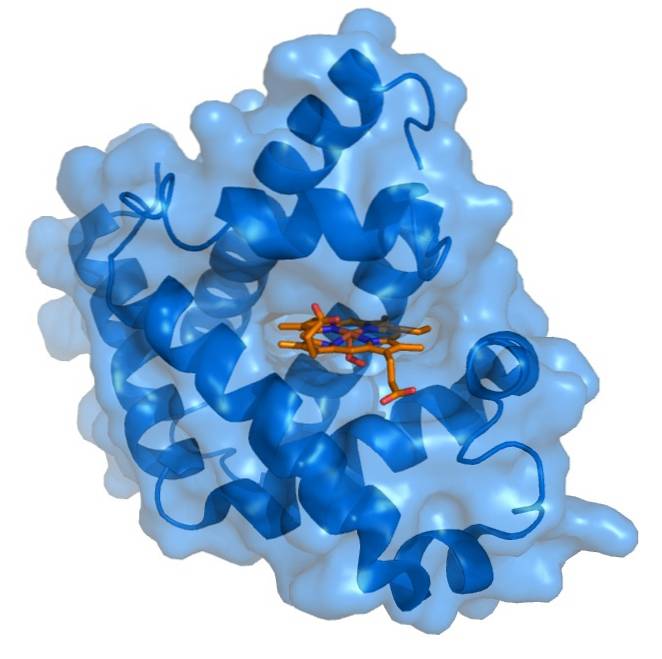
Myoglobin má velmi kompaktní strukturu, přičemž hydrofobní zbytky směřují dovnitř a hydrofilní nebo polární zbytky směřují ven. Vnitřní nepolární zbytky jsou tvořeny leucinem, valinem, methioninem a fenylalaninem. Jedinými vnitřními polárními zbytky jsou dva histidiny, které mají funkce v aktivním centru..
Hemová protetická skupina je umístěna v rozštěpu apolární vnitřní části polypeptidového řetězce myoglobinu. Tato skupina obsahuje železo ve formě železného železa, které se váže s kyslíkem za vzniku oxymyoglobinu..
Funkce
Funkce myoglobinu spočívá v navázání kyslíku na hemovou skupinu jeho struktury a vytvoření kyslíkové rezervy pro funkci svalů. Protože kyslík je zachycen ve struktuře myoglobinu v cytoplazmě svalové buňky, jeho intracelulární tlak stanovený volným kyslíkem zůstává nízký..
Nízký intracelulární tlak kyslíku udržuje gradient pro vstup kyslíku do buňky. To podporuje průchod kyslíku z krevního oběhu do svalové buňky. Když je myoglobin nasycen, zvyšuje se intracelulární kyslík, který postupně snižuje gradient a tím snižuje přenos.
Vazebná křivka kyslíku na myoglobin je hyperbolická. V počátečních částech křivky způsobují malé změny parciálního tlaku kyslíku velké změny v nasycení myoglobinu kyslíkem..
Poté, jak se zvyšuje parciální tlak kyslíku, saturace dále roste, ale pomaleji, to znamená, že pro zvýšení saturace myoglobinu je zapotřebí mnohem většího zvýšení parciálního tlaku kyslíku a křivka se postupně zplošťuje.
Existuje proměnná, která měří afinitu křivky zvanou P50, což představuje parciální tlak kyslíku nezbytný k nasycení myoglobinu obsaženého v roztoku o 50%. Pokud se tedy zvyšuje P50, říká se, že myoglobin má nižší afinitu a pokud se P50 snižuje, říká se, že myoglobin má vyšší afinitu ke kyslíku..
Při zkoumání vazebných křivek kyslíku pro myoglobin a hemoglobin se pozoruje, že při jakémkoli zkoumaném parciálním tlaku kyslíku se myoglobin stává nasycenějším než hemoglobin, což naznačuje, že myoglobin má vyšší afinitu ke kyslíku než hemoglobin..
Druhy svalových vláken a myoglobinu
Kosterní svaly mají ve svém složení různé typy svalových vláken, některé se nazývají pomalé a jiné rychlé. Vlákna rychlého škubání jsou strukturálně a metabolicky přizpůsobena ke kontrakci rychle a energicky a anaerobně.
Pomalá záškubová vlákna jsou přizpůsobena pro pomalejší, ale delší kontrakce typické pro odporové aerobní cvičení. Jedním ze strukturních rozdílů těchto vláken je koncentrace myoglobinu, která jim dává název bílých a červených vláken..
Červená vlákna mají vysoký obsah myoglobinu, který jim dodává červenou barvu, ale také jim umožňuje udržovat velké množství kyslíku, což je nezbytné pro jejich funkci..
Normální hodnoty
Normální hodnoty v krvi pro muže jsou 19 až 92 µg / l a pro ženy 12 až 76 µg / l, nicméně existují rozdíly v hodnotách v různých laboratořích..
Tyto hodnoty se zvyšují, když dojde ke zničení svalstva, jako je tomu u rhabdomyolýzy kosterního svalstva, rozsáhlých popálenin, úrazu elektrickým proudem nebo rozsáhlé nekrózy svalů v důsledku arteriální okluze, infarktu myokardu a některých myopatií..
Za těchto podmínek se myoglobin objevuje v moči a dodává mu charakteristickou barvu..
Reference
- Fauci, A. S., Kasper, D. L., Hauser, S. L., Jameson, J. L. a Loscalzo, J. (2012). Harrisonovy principy vnitřního lékařství. D. L. Longo (ed.). New York: Mcgraw-hill
- Ganong WF: Centrální regulace viscerální funkce, in Recenze lékařské fyziologie, 25. vydání New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Oddíly tělních tekutin: Extracelulární a intracelulární tekutiny; Edém, v Učebnice lékařské fyziologie, 13. vydání, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- McCance, K.L., a Huether, S.E. (2018). Pathophysiology-Ebook: biologický základ pro onemocnění u dospělých a dětí. Elsevier Health Sciences.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harperova ilustrovaná biochemie. Mcgraw-kopec.



Zatím žádné komentáře