
Současné charakteristiky atomového modelu, postuláty a vlivní vědci

The aktuální atomový model je ten, který je založen na kvantové mechanice, zejména na Schrödingerově rovnici, na Pauliho vylučovacím principu a vlastnosti elektronu zvané roztočit nebo roztočit.
Jedná se o nejuznávanější a nejpoužívanější model při studiu struktury atomů, molekul a chemické reaktivity prvků, a to díky přesnosti jeho předpovědí a jeho relativní jednoduchosti..

Tento model je vývojem několika předchozích atomových modelů, jako je Rutherfordův model a Bohr-Sommerfeldův model, považované za klasické nebo poloklasické modely..
V současné době existuje teoreticky úplnější modely než Schrödingerův kvantově-mechanický model, jako je Dirac-Jordanův model, který zahrnuje speciální relativitu a je založen na Diracově vlnové rovnici. V této rovnici se přirozeně objevuje spin, vlastnost elektronů zmíněná na začátku.
Existují také modely založené na kvantové teorii pole používané ve fyzice vysokých energií. Tyto modely výborně předpovídají vznik a zničení základních částic, což je cíl tohoto pole fyziky..
Stojí za zmínku, že nejsofistikovanější teorie konvergují ke stejným výsledkům jako Schrödingerova rovnice, zejména pro atomy světla..
Rejstřík článků
- 1 Charakteristika současného atomového modelu
- 1.1 Vlna - dualita částic
- 1.2 Velikost atomu
- 2 Postuláty současného atomového modelu
- 3 Vědci ovlivňující současný atomový model
- 4 Články zájmu
- 5 Reference
Charakteristika současného atomového modelu
V současném pohledu na atom, založeném na nerelativistické kvantové mechanice, koncept elektronických drah ve stylu planetárních systémů nesedí.
Nejrozšířenějším obrazem atomu je však stále obraz pozitivního centrálního jádra a několika bodů negativního elektrického náboje (elektronů), rotujících na dokonale definovaných drahách kolem centrálního jádra. Ale navzdory svým kořenům již neodpovídá současnému atomovému modelu.
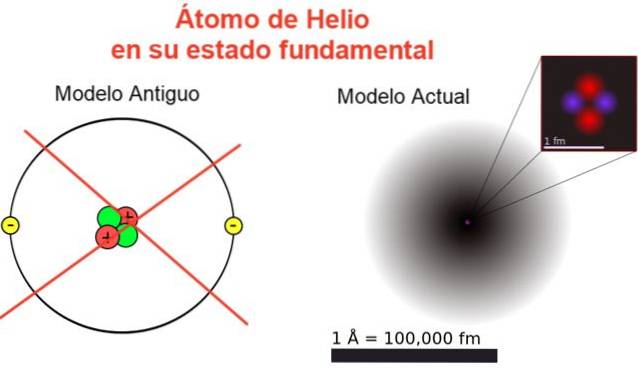
Obrázek 2 ukazuje starý snímek a aktuální obrázek atomu helia v jeho stavu s nejnižší energií (úroveň n = 1 al = 0).
Klasický obrázek je užitečný pro zjištění, že jádro obsahuje dva protony a dva neutrony. K zajištění neutrality atomu existují dva elektrony, které zaujímají stejnou energetickou hladinu.
Zbytek je obraz daleko od reality, protože měřítko jádra neodpovídá ani měřítku atomu: jádro je 1/100 000krát větší než atom, ale tam se koncentruje atomová hmota.
Vlna - dualita částic
Klasická mechanika stanoví, že každá částice materiálu má přidruženou vlnu, tzv vlnová funkce. Tohle je slavný dualita vlnových částic Louis De Broglie.
V současném atomovém modelu je chování elektronu v měřítku atomů prominentně vlnové, zatímco na makroskopické úrovni převládá korpuskulární chování, podobně jako elektrony pohybující se v katodových trubicích starých televizních přijímačů..
Na druhou stranu u fotonů se stává pravý opak, u většiny optických jevů (na makroskopické úrovni) mají zásadní vlnové chování. A když interagují s atomy hmoty, mají chování částic.
Z tohoto důvodu jsou elektrony kolem jádra rozptýleny v tzv. Oblastech atomové orbitaly, jehož tvar a rozsah bude záviset na energetické úrovni elektronů a momentu hybnosti.
Jak energie, tak moment hybnosti elektronu kolem jádra mají určité povolené hodnoty, proto se o nich říká kvantováno.
Schrödingerova vlnová rovnice předpovídá, které hodnoty energie a momentu hybnosti jsou povoleny, stejně jako vlnová funkce spojená s každou úrovní energie a hybností..
Matematický čtverec vlnové funkce určuje orbitaly, tj. Oblasti kolem jádra, kde lze s větší pravděpodobností nalézt elektrony.
Velikost atomu
Chcete-li mít zmenšený obrázek aktuálního atomového modelu, představme si, že atom má průměr podobný průměru fotbalového hřiště. Jádro by vypadalo jako mravenec ve středu pole, ale úžasně s 99,9% atomové hmotnosti.
Na druhou stranu by elektrony byly jako přízrační hráči rozptýlení po celém poli, s větší pravděpodobností, že budou nalezeni ve středu pole..
Existuje několik zarovnání nebo povolených způsobů obsazení pole, které závisí na energii hráčů (elektronů) a množství „otáčení“ nebo otáčení kolem středu..
Postuláty současného atomového modelu
1.- Elektron je charakterizován svou hmotností m, rotací s a protože je to částice nesoucí záporný náboj elementu (-e).
2. - Elektrony mají dvojí chování, simultánní vlnovou částici, ale v závislosti na jejich energii a rozsahu jevu může být jeden převládající než druhý..
3.- Elektrony obklopují kladné atomové jádro takovým způsobem, že zaručují elektrickou neutralitu atomu. Proto se počet elektronů rovná počtu protonů; To je protonové číslo, což dává chemické a fyzikální vlastnosti každého prvku.
4.- Interakce mezi elektrony a jádrem je modelována potenciálem V (r) elektrostatický Coulomb, ke kterému je v hamiltonovském operátoru začleněn termín potenciální energie.
5. - Termín kinetické energie v hamiltonovském operátoru je operátor, který je sestrojen z operátoru lineární hybnosti a je stejný:
p = - i ħ ∂ / ∂r
Kde ħ je Planckova konstanta dělená 2π.
6. - Hamiltonovský operátor H = (p⋅p)/ 2 m - e V (r) působí na funkci elektronových vln Ψ (r).
7. - Protože se hledají stacionární řešení funkce elektronických vln, používá se časově nezávislá Schrödingerova rovnice:
H Ψ (r) = E Ψ (r)
Kde E představuje celkovou energii elektronu.
8. - U atomů s několika elektrony se interakce mezi nimi nebere v úvahu.
9. - Pokud jde o atomy mnoha elektronů, orbitály nejvzdálenějších elektronů jsou modelovány potenciálem jádra stíněného nejvnitřnějšími elektrony, který je známý jako Debyeův potenciál.
10.- Rovnice (7) má řešení pro některé diskrétní energetické hodnoty, takže je známá planckovy kvantá, se přirozeně objevují z řešení Schrödingerovy rovnice.
11.- Pro každou diskrétní hodnotu E existuje vlnová funkce. Některá řešení jsou ale zdegenerovaná, v závislosti na hodnotě momentu hybnosti L.
12.- Vlnová funkce je součinem radiální funkce, azimutální funkce a polární funkce.
13.- Tato vlnová funkce určuje oblasti povolené pro elektron. Čtverec vlnové funkce je hustota pravděpodobnosti najít elektron v určité poloze při pohledu ze středu atomového jádra.
14.- Spin se neobjevuje v Schrödingerově rovnici, ale je začleněn do atomového modelu prostřednictvím Pauliho principu:
Elektron je fermion se dvěma možnými stavy rotace + ½ a -½.
Stejný stav charakterizovaný kvantovými čísly n, l, m Schrödingerovy rovnice, tedy může být obsazen nanejvýš 2 elektrony s opačnými rotacemi. Tímto způsobem se rotace stává čtvrtým kvantovým číslem.
Vlivní vědci v současném atomovém modelu
Zdá se to neuvěřitelné, ale většina fyziků, kteří přispěli k současnému atomovému modelu, se objevuje na stejné fotografii. Setkali se na slavných konferencích sponzorovaných Ernestem Solvayem, chemikem a průmyslníkem belgického původu, který se proslavil ve světě vědy.
Začali se konat v roce 1911 a sdružovali největší vědce současnosti, mezi nimiž byli prakticky všichni, kteří přispěli k současnému atomovému modelu.
Nejslavnější z těchto konferencí se konala v Bruselu v roce 1927 a byla zde pořízena tato historická fotografie:


- Peter Debye
- Irving langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Emile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Edouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max se narodil
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Brillouin
- Niels Bohr
- Owen Williams Richardson
Články zájmu
Schrödingerův atomový model.
Atomový model de Broglie.
Chadwickův atomový model.
Heisenbergův atomový model.
Perrinův atomový model.
Thomsonův atomový model.
Daltonův atomový model.
Atomový model Dirac Jordan.
Atomový model Demokrita.
Atomový model Leucippus.
Bohrův atomový model.
Reference
- Alonso - Finn. Kvantové a statistické základy. Addison Wesley.
- Bauer, W. 2011. Fyzika pro inženýrství a vědy. Svazek 1. Mc Graw Hill.
- Eisberg a Resnick. Kvantová fyzika. Limusa - Wiley.
- Wikipedia. Atomová teorie. Obnoveno z: es.wikipedia.com
- Zapata F. Kvantově-mechanický model atomu. Obnoveno z: lifeder.com



Zatím žádné komentáře