
Dipólový moment, jak se počítá, a příklady
The dipólový moment je chemická vlastnost, která udává, jak heterogenně jsou elektrické náboje distribuovány v molekule. Vyjadřuje se v jednotkách Debye, 3,33 · 10-30 C · m a obecně se jeho hodnoty pohybují od 0 do 11 D..
Vysoce polární sloučeniny mívají velké dipólové momenty; zatímco ty nepolární, malé dipólové momenty. Čím polarizovanější jsou elektrické náboje v molekule, tím větší je jeho dipólový moment; to znamená, že musí existovat oblast bohatá na elektrony δ- a další chudá na elektrony δ+.

Dipólový moment μ je vektorová velikost, takže je ovlivněna úhly vazeb a obecně molekulární strukturou.
Když je molekula lineární, lze ji přirovnat k dvoubarevné gumě. Jeho negativní konec δ- by odpovídal červené barvě; zatímco kladné, δ +, bude modrá barva. Jak se zvětšují velikosti záporných nábojů na δ-pólu a vzdálenost, která jej odděluje od δ +, zvyšuje se dipólový moment.
Chemicky to znamená, že čím větší je rozdíl v elektronegativitě mezi dvěma atomy, a čím delší je vzdálenost, která je odděluje, tím větší je dipólový moment mezi nimi..
Rejstřík článků
- 1 Jak se počítá dipólový moment?
- 2 Příklady
- 2.1 Voda
- 2.2 Metanol
- 2.3 Amoniak
- 2.4 Ethanol
- 2,5 Oxid uhličitý
- 2.6 Metan
- 3 Odkazy
Jak vypočítáte dipólový moment?
Je považována za kovalentní vazbu mezi dvěma atomy, A a B:
A-B
Vzdálenost mezi kladným a záporným dílčím nábojem je již definována délkou jejich vazby:
NAδ+-Bδ-
Protože protony a elektrony mají stejnou velikost elektrického náboje, ale s opačnými znaménky, 1,6 · 10-19C, toto je vzato v úvahu při hodnocení dipólového momentu mezi A a B pomocí následující rovnice:
μ = δd
Kde μ je dipólový moment, δ je náboj elektronu bez záporného znaménka a d délka odkazu vyjádřená v metrech. Například za předpokladu, že d má hodnotu 2 Å (1 10-10m) dipólový moment, μA-B bude:
μA-B = (1,6 10-19C) · (2,10-10m)
= 3,210-29Cm
Ale protože je tato hodnota velmi malá, používá se jednotka Debye:
μ = (3210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D.
Tato hodnota μA-B by mohla vést k předpokladu, že vazba A-B je více iontová než kovalentní.
Příklady
Voda
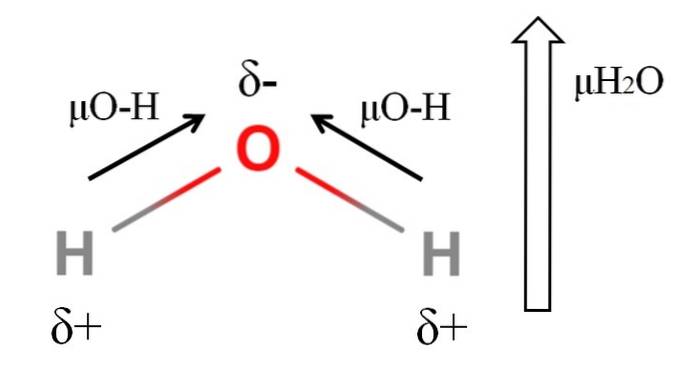
Pro výpočet dipólového momentu molekuly musí být všechny dipólové momenty jejich příslušných vazeb přičteny vektorově, s ohledem na úhly vazby a trochu trigonometrie. To na začátku.
Voda má jeden z největších dipólových momentů, které lze u kovalentní sloučeniny očekávat. Na horním obrázku máme, že atomy vodíku mají kladné částečné náboje, δ +, zatímco kyslík nese záporný částečný náboj, δ-. Vazba O-H je poměrně polární (1,5 D) a v molekule H jsou dvadvaNEBO.
Obvykle je nakreslen vektor, který je směrován od nejméně elektronegativního atomu (H) k nejvíce elektronegativnímu atomu (O). I když nejsou nakresleny, na atomu kyslíku jsou dva páry nesdílených elektronů, které dále „koncentrují“ negativní oblast..
Vzhledem k úhlové geometrii HdvaNebo se dipólové momenty přidávají ve směru atomu kyslíku. Všimněte si, že součet dvou μO-H by poskytl 3D (1,5 + 1,5); ale není to tak. Dipólový moment vody má experimentální hodnotu 1,85D. Zde je zobrazen účinek blízkého úhlu 105 ° mezi vazbami H-O-H..
Methanolu
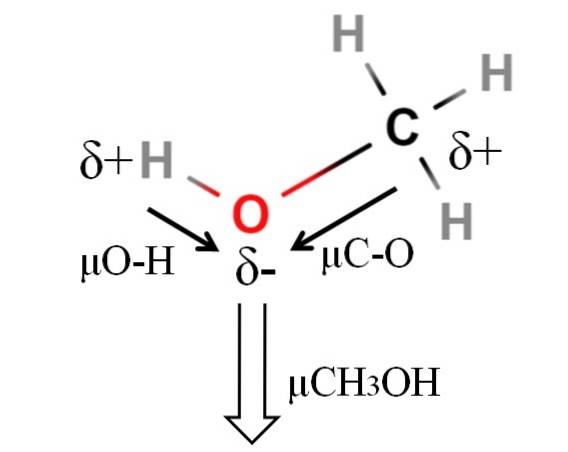
Dipólový moment methanolu je 1,69 D. Je to méně než u vody. Atomové hmotnosti proto nemají velký vliv na dipólový moment; ale jejich atomové poloměry jsou. V případě methanolu nemůžeme potvrdit, že jeho H-O vazba má μ rovné 1,5D; protože v CH jsou molekulární prostředí odlišná3OH a HdvaNEBO.
Proto by pro výpočet μO-H musela být změřena délka vazby H-O v methanolu. Lze říci, že μO-H je větší než μC-O, protože rozdíl elektronegativity mezi uhlíkem a kyslíkem je menší než mezi vodíkem a kyslíkem..
Metanol je uveden jako jedno z nejpolárnějších rozpouštědel, které lze nalézt spolu s vodou a amoniakem..
Amoniak
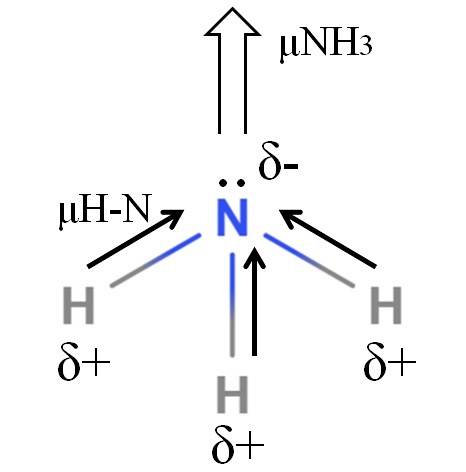
Vazby H-N jsou poměrně polární, takže dusík díky své vyšší elektronegativitě přitahuje elektrony k sobě (horní obrázek). Kromě toho na něm máme nesdílený pár elektronů, které přispívají svými zápornými náboji do oblasti δ-. Proto na atomu dusíku amoniaku převládají elektrické náboje..
Amoniak má dipólový moment 1,42 D, menší než u methanolu. Pokud by se amoniak i methanol mohly přeměnit na průvan, bylo by vidět, že tah methanolu má ve srovnání s průvanem čpavkem více definovaných pólů.
Ethanol
V případě ethanolu CH3CHdvaOH, jeho dipólový moment je velmi blízký momentu methanolu, ale má tendenci mít nižší hodnoty. Protože existuje více atomů uhlíku tvořících oblast δ +, atom kyslíku představující δ- začíná ztrácet trochu své „relativní negativní intenzity“.
Oxid uhličitý
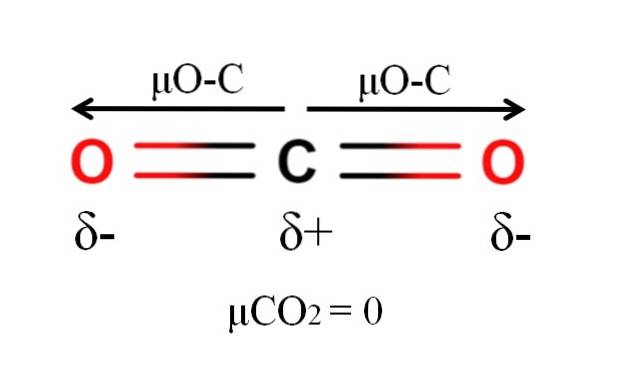
Oxid uhličitý má dvě polární vazby, C = O, s příslušnými dipólovými momenty μO-C. Jak je však vidět na obrázku výše, lineární geometrie COdva způsobí, že se dva μO-C navzájem vektorově ruší, i když uhlík má kladný částečný náboj a kyslíky mají záporné částečné náboje.
Z tohoto důvodu je oxid uhličitý nepolární molekulou, protože μCOdva má hodnotu 0D.
Metan
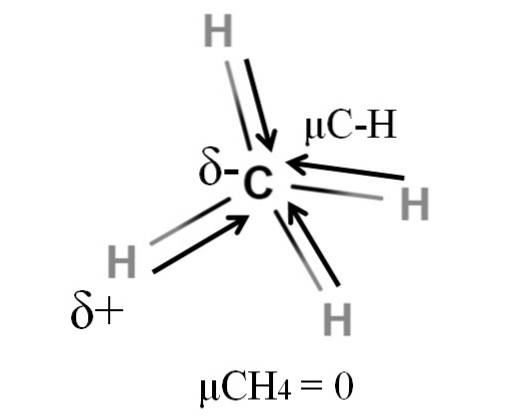
Metan i oxid uhličitý mají něco společného: jsou to vysoce symetrické molekuly. Obecně platí, že čím symetrickější je molekula, tím menší je její dipólový moment..
Pokud vidíme molekulu CH4, jeho CH vazby jsou polární a elektrony směřují k atomu uhlíku, protože je o něco elektronegativnější. Mohlo by se domnívat, že uhlík bude muset být vysoce negativní δ- oblast; jako guma s tmavě červeným středem a namodralými konci.
Avšak dělením CH4 na polovinu bychom dostali dvě poloviny H-C-H, jednu nalevo a druhou napravo, podobně jako molekula HdvaO. Dipólový moment vyplývající z přidání těchto dvou μC-H by se tedy zrušil s momentem druhé poloviny. A proto μCH4 má hodnotu 0D.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Walter J. Moore. (1963). Fyzikální chemie. V chemické kinetice. Čtvrté vydání, Longmans.
- Ira N. Levine. (2009). Principy fyzikálně-chemické. Šesté vydání, str. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29. ledna 2020). Definice dipólového momentu. Obnoveno z: thoughtco.com
- Blaber Mike. (29. září 2019). Dipole Moments. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- LaRita Williams. (2020). Dipólový moment: definice, rovnice a příklady. Studie. Obnoveno z: study.com
- Wikipedia. (2020). Bond dipólový moment. Obnoveno z: en.wikipedia.org


Zatím žádné komentáře