
Hromadné číslo, z čeho se skládá a jak jej získat (s příklady)

The hromadné číslo Hmotnostní číslo atomu je součtem počtu protonů a počtu neutronů v jádře. Tyto částice jsou zaměnitelně označovány názvem nukleony, proto hmotnostní číslo představuje jejich množství.
Nechť N je počet přítomných neutronů a Z počet protonů, pokud nazýváme A jako hromadné číslo, pak:
A = N + Z
Rejstřík článků
- 1 Příklady hromadných čísel
- 1.1 Vodík
- 1.2 Kyslík
- 1,3 uhlík
- 1.4 Uran
- 2 Jak získat číslo hmotnosti?
- 2.1 Zápis pro atomy
- 3 izotopy
- 3.1 Izotopy uhlíku
- 4 Pracované příklady
- 4.1 - Příklad 1
- 4.2 - Příklad 2
- 5 Reference
Příklady hromadných čísel
Zde je několik příkladů hromadných čísel pro dobře známé prvky:
Vodík
Nejstabilnější a nejhojnější atom vodíku je také nejjednodušší: 1 proton a jeden elektron. Jelikož jádro vodíku nemá neutrony, je pravda, že A = Z = 1.
Kyslík
Kyslíkové jádro má 8 neutronů a 8 protonů, tedy A = 16.
Uhlík
Život na Zemi je založen na chemii uhlíku, světelného atomu se 6 protony v jádru plus 6 neutronů, takže A = 6 + 6 = 12.
Uran
Tento prvek, mnohem těžší než předchozí, je dobře známý pro své radioaktivní vlastnosti. Jádro uranu má 92 protonů a 146 neutronů. Pak je jeho hmotnostní číslo A = 92 + 146 = 238.
Jak získat hromadné číslo?
Jak již bylo zmíněno dříve, hmotnostní číslo A prvku vždy odpovídá součtu počtu protonů a počtu neutronů, které jeho jádro obsahuje. Je to také celé číslo, ale ... existuje nějaké pravidlo týkající se vztahu mezi těmito dvěma veličinami??
Uvidíme: všechny výše uvedené prvky jsou lehké, kromě uranu. Atom vodíku je, jak jsme řekli, nejjednodušší. Nemá neutrony, přinejmenším ve své nejhojnější verzi, a v kyslíku a uhlíku je stejný počet protonů a neutronů.
Stává se to také s jinými světelnými prvky, jako je dusík, další velmi důležitý plyn pro život, který má 7 protonů a 7 neutronů. Jak se však jádro stává složitějším a atomy těžší, počet neutronů se zvyšuje jinou rychlostí..
Na rozdíl od lehkých prvků má uran s 92 protony přibližně 1 ½násobek tohoto množství v neutronech: 1 ½ x 92 = 1,5 x 92 = 138.
Jak vidíte, blíží se 146, což je množství neutronů, které má.
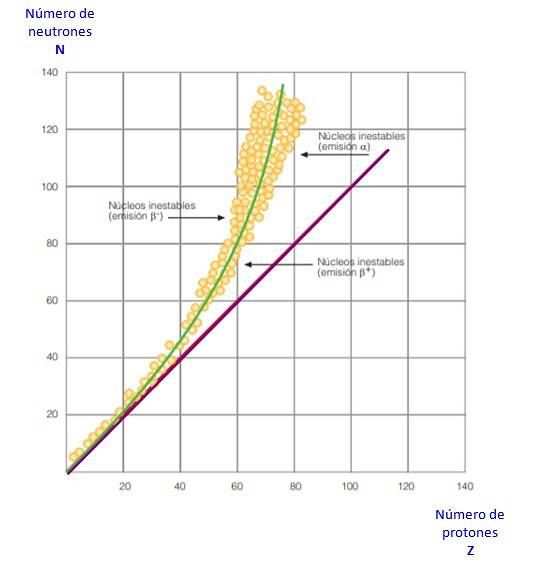
To vše je patrné z křivky na obrázku 2. Je to graf N proti Z, známý jako křivka jaderné stability. Zde vidíte, jak mají lehké atomy stejný počet protonů jako neutrony a jak se od Z = 20 zvyšuje počet neutronů..
Tímto způsobem se velký atom stává stabilnějším, protože přebytek neutronů snižuje elektrostatický odpor mezi protony..
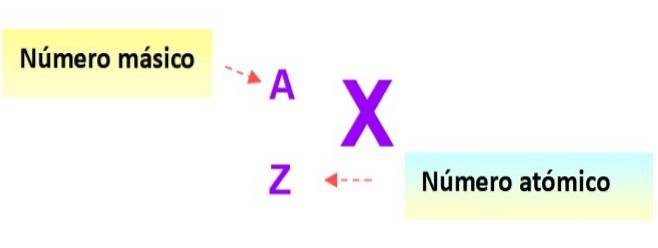
Zápis pro atomy
Velmi užitečná notace, která rychle popisuje typ atomu, je následující: symbol prvku a příslušná atomová a hmotnostní čísla jsou zapsána, jak je znázorněno níže v tomto diagramu:
V této notaci by atomy v předchozích příkladech byly:
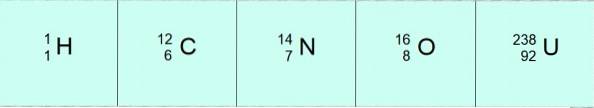
Někdy se používá jiná pohodlnější notace, ve které se k označení atomu používá pouze symbol prvku a hmotnostní číslo, přičemž se vynechá atomové číslo. Tímto způsobem 12 6C se jednoduše píše jako uhlík-12, 16 8Nebo by to byl kyslík-16 atd. Pro jakýkoli prvek.
Izotopy
Počet protonů v jádru určuje povahu prvku. Například každý atom, jehož jádro obsahuje 29 protonů, je atom mědi, bez ohledu na to, co se děje..
Předpokládejme, že atom mědi ztratí elektron z jakéhokoli důvodu, stále je to měď. Nyní je to však ionizovaný atom.
Pro atomové jádro je obtížnější získat nebo ztratit proton, ale v přírodě k tomu může dojít. Například uvnitř hvězd se z lehkých prvků kontinuálně tvoří těžší prvky, protože hvězdné jádro se chová jako fúzní reaktor..
A právě tady na Zemi je fenomén radioaktivní rozpad, ve kterém některé nestabilní atomy vylučují nukleony a emitují energii a transformují se do dalších prvků.
Nakonec existuje možnost, že atom určitého prvku má jiné hmotnostní číslo, v tomto případě je to a izotop.
Dobrým příkladem je známý uhlík-14 nebo radiokarbon, který se používá k datování archeologických objektů a jako biochemický indikátor. Je to stejný uhlík se stejnými chemickými vlastnostmi, ale se dvěma neutrony navíc.
Uhlík-14 je méně hojný než uhlík-12, stabilní izotop, a je také radioaktivní. To znamená, že v průběhu času se rozpadá emitující energii a částice, dokud se nestane stabilním prvkem, kterým je v jeho případě dusík..
Uhlíkové izotopy
Uhlík v přírodě existuje jako směs několika izotopů, z nichž nejhojnější je již zmíněný 12 6C nebo uhlík-12. A kromě uhlíku-14 existuje 13 6C s dalším neutronem.
To je v přírodě běžné, například o cínu je známo 10 stabilních izotopů. Na druhou stranu, z berylia a sodíku je znám pouze jediný izotop.
Každý izotop, přirozený nebo umělý, má jinou rychlost transformace. Stejným způsobem je možné v laboratoři vytvářet umělé izotopy, které jsou obecně nestabilní a radioaktivně se rozpadají ve velmi krátkém zlomku sekundy, zatímco jiným trvá mnohem déle, pokud věk Země nebo více ..
Tabulka přírodních izotopů uhlíku
| Uhlíkové izotopy | Atomové číslo Z | Hmotnost číslo A | Hojnost% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98,89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Stopy |
Pracoval příklady
- Příklad 1
Jaký je rozdíl mezi 13 7 N a 14 7 N?
Odpovědět
Oba jsou atomy dusíku, protože jejich atomové číslo je 7. Avšak jeden z izotopů, ten s A = 13, má o jeden neutron méně, zatímco 14 7 N je nejhojnější izotop.
- Příklad 2
Kolik neutronů je v jádru atomu rtuti, označeno jako 201 80 Hg?
Odpovědět
Protože A = 201 a Z = 80, a také s vědomím, že:
A = Z + N
N = A - Z = 201 - 80 = 121
A dochází k závěru, že atom rtuti má 121 neutronů.
Reference
- Connor, N. Co je Nucleon - Struktura atomového jádra - Definice. Obnoveno z: periodic-table.org.
- Knight, R. 2017. Fyzika pro vědce a inženýrství: strategický přístup. Pearson.
- Sears, Zemansky. 2016. Univerzitní fyzika s moderní fyzikou. 14. Vydání Volume 2.
- Tippens, P. 2011. Fyzika: koncepty a aplikace. 7. vydání. Mcgraw kopec.
- Wikipedia. Hromadné číslo. Obnoveno z: en.wikipedia.org.

Zatím žádné komentáře