
Klíčové vlastnosti (se vzorci)
The společný majetek je jakákoli vlastnost látky, která závisí na počtu částic v ní obsažených (nebo se liší v závislosti na něm) (ve formě molekul nebo atomů), bez závislosti na povaze těchto částic.
Jinými slovy, lze je také vysvětlit jako vlastnosti roztoků, které závisí na vztahu mezi počtem částic rozpuštěné látky a počtem částic rozpouštědla. Tento koncept představil v roce 1891 německý chemik Wilhelm Ostwald, který klasifikoval vlastnosti rozpuštěné látky do tří kategorií.

Tyto kategorie prohlašovaly, že koligativní vlastnosti závisí pouze na koncentraci a teplotě rozpuštěné látky a nikoli na povaze jejích částic..
Kromě toho aditivní vlastnosti, jako je hmotnost, závisely na složení rozpuštěné látky a konstituční vlastnosti závisely spíše na molekulární struktuře rozpuštěné látky..
Rejstřík článků
- 1 Společné vlastnosti
- 1.1 Pokles tlaku par
- 1.2 Zvýšení teploty varu
- 1.3 Snížení teploty mrazu
- 1.4 Osmotický tlak
- 2 Odkazy
Koligativní vlastnosti
Koligativní vlastnosti jsou studovány hlavně pro zředěná řešení (vzhledem k jejich téměř ideálnímu chování) a jsou následující:
Snížení tlaku par
Dá se říci, že tlak par kapaliny je rovnovážný tlak molekul par, se kterými je kapalina v kontaktu..
Podobně je vztah těchto tlaků vysvětlen Raoultovým zákonem, který vyjadřuje, že parciální tlak složky se rovná součinu molárního podílu složky tlakem par složky v jejím čistém stavu:
PNA = XNA . PºNA
V tomto výrazu:
PNA = Částečný tlak par složky A ve směsi.
XNA = Mole zlomek složky A.
PºNA= Tlak páry čisté složky A.
V případě snížení tlaku par rozpouštědla k tomu dojde, když se k němu přidá netěkavá rozpuštěná látka za vzniku roztoku. Jak je známo a podle definice, netěkavá látka nemá tendenci se odpařovat.
Z tohoto důvodu platí, že čím více této rozpuštěné látky se přidá k těkavému rozpouštědlu, tím nižší bude tlak par a méně rozpouštědla může uniknout do plynného stavu..
Takže když se rozpouštědlo odpaří přirozeně nebo násilně, nakonec zůstane množství rozpouštědla bez odpařování spolu s netěkavou solutem..
Tento jev lze lépe vysvětlit konceptem entropie: když molekuly přecházejí z kapalné fáze do plynné fáze, zvyšuje se entropie systému..
To znamená, že entropie této plynné fáze bude vždy větší než v kapalném stavu, protože molekuly plynu zaujímají větší objem..
Pak, pokud se entropie kapalného stavu zvýší zředěním, i když je spojena s rozpuštěnou látkou, rozdíl mezi těmito dvěma systémy se zmenší. Z tohoto důvodu snížení entropie také snižuje tlak par..
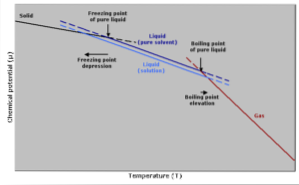
Nárůst teploty varu
Bod varu je teplota, při které je rovnováha mezi kapalnou a plynnou fází. V tomto okamžiku se počet molekul plynu, které se stávají kapalnými (kondenzují), rovná počtu kapalných molekul odpařujících se na plyn..
Přidání rozpuštěné látky způsobí zředění koncentrace kapalných molekul, což způsobí snížení rychlosti odpařování. Tím se vytvoří změna bodu varu, aby se vyrovnala změna koncentrace rozpouštědla..
Jinými slovy, teplota varu roztoku je vyšší než teplota varu rozpouštědla v jeho čistém stavu. To je vyjádřeno matematickým výrazem zobrazeným níže:
ΔTb = i. K.b . m
V tomto výrazu:
ΔTb = Tb (řešení) - Tb (rozpouštědlo) = změna teploty varu.
i = van't Hoffův faktor.
K.b = Varná konstanta rozpouštědla (0,512 ° C / mol pro vodu).
m = Molalita (mol / kg).
Snížení teploty pod bodem mrazu
Teplota tuhnutí čistého rozpouštědla se sníží, když se přidá určité množství rozpuštěné látky, protože je ovlivněna stejným jevem, jako je pokles tlaku par..
Stává se to proto, že snížením tlaku par rozpouštědla zředěním rozpuštěné látky bude zapotřebí nižší teplota, aby došlo k jeho zamrznutí..
Pro vysvětlení tohoto jevu lze také vzít v úvahu povahu procesu zmrazování: aby kapalina zmrzla, musí dosáhnout uspořádaného stavu, ve kterém nakonec vytvoří krystaly..
Pokud jsou v kapalině nečistoty ve formě rozpuštěných látek, bude kapalina méně uspořádaná. Z tohoto důvodu bude mít roztok větší potíže se zmrazením než rozpouštědlo bez nečistot..
Toto snížení je vyjádřeno jako:
ΔTF = -i. K.F . m
Ve výše uvedeném výrazu:
ΔTF = TF (řešení) - TF (rozpouštědlo) = změna teploty mrazu.
i = van't Hoffův faktor.
K.F = Konstanta tuhnutí rozpouštědla (1,86 ° C kg / mol pro vodu).
m = Molalita (mol / kg).
Osmotický tlak
Proces známý jako osmóza je tendence rozpouštědla procházet semipermeabilní membránou z jednoho roztoku do druhého (nebo z čistého rozpouštědla do roztoku).
Tato membrána představuje bariéru, kterou mohou procházet některé látky a jiné nikoli, jako v případě polopropustných membrán v buněčných stěnách živočišných a rostlinných buněk..
Osmotický tlak je pak definován jako minimální tlak, který musí být aplikován na roztok, aby se zastavil průchod jeho čistého rozpouštědla polopropustnou membránou..
Je také známá jako míra tendence roztoku přijímat čisté rozpouštědlo v důsledku účinku osmózy. Tato vlastnost je koligativní, protože závisí na koncentraci rozpuštěné látky v roztoku, která je vyjádřena jako matematický výraz:
Π. V = n. R. T, nebo také π = M. R. T
V těchto výrazech:
n = počet molů částic v roztoku.
R = univerzální plynová konstanta (8,314472 J. K.-1 . krtek-1).
T = teplota v Kelvinech.
M = molarita.
Reference
- Wikipedia. (s.f.). Koligativní vlastnosti. Citováno z en.wikipedia.org
- PŘED NAŠÍM LETOPOČTEM. (s.f.). Koligativní vlastnosti. Obnoveno z opentextbc.ca
- Bosma, W. B. (s.f.). Koligativní vlastnosti. Obnoveno z chemistryexplained.com
- Sparknotes. (s.f.). Koligativní vlastnosti. Obnoveno z sparknotes.com
- University, F. S. (s.f.). Koligativní vlastnosti. Obnoveno z chem.fsu.edu


Zatím žádné komentáře