
Typy a funkce proteolýzy

The proteolýza o degradace proteinů je proces, při kterém mohou být proteiny buňky úplně degradovány (až na jejich aminokyseliny, které tvoří) nebo částečně (produkující peptidy). To znamená, že spočívá v hydrolýze jedné nebo více peptidových vazeb, které drží své aminokyseliny pohromadě..
K tomuto procesu může dojít díky účasti dalších proteinů s enzymatickou aktivitou, na jejichž aktivních místech dochází k hydrolýze vazeb. Může se také vyskytnout neenzymatickými „metodami“, například působením tepla nebo látek s extrémním pH (velmi kyselé nebo velmi zásadité).
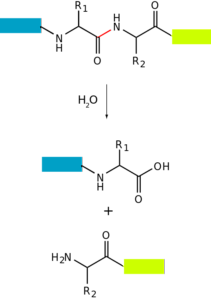
K degradaci bílkovin dochází u bakterií, zvířat a rostlin, ale je to zvláště běžné u zvířat, zejména na úrovni trávicího systému, protože na tom závisí trávení a absorpce bílkovin požitých ve střevě..
Kromě toho je proteolýza nanejvýš důležitá pro funkční údržbu a regulaci mnoha buněčných procesů a souvisí také s eliminací těch proteinů, které vykazují chyby v překladu, skládání, balení, importu, provozu atd..
Je důležité zdůraznit, že jde o nevratný, vysoce účinný proces, který funguje také při „regulaci regulátorů“, protože vylučuje nejen ty proteiny, které mají „přímé“ biologické aktivity, ale také ty, které regulují jiné proteiny nebo expresi odpovídajících genů.
Rejstřík článků
- 1 Druhy proteolýzy
- 1.1 Ubikvitinační proteolýza
- 1.2 Proteolýza autofagií
- 1.3 Neenzymatická proteolýza
- 2 funkce
- 2.1 V imunitním systému
- 2.2 Další funkce
- 2.3 V rostlinách
- 3 Odkazy
Druhy proteolýzy
Vnitřní proteiny buňky mohou být degradovány náhodně nebo selektivně nebo, co je stejné, kontrolovaným způsobem nebo ne. Na druhé straně, jak již bylo zmíněno, k tomuto procesu může dojít pomocí speciálních enzymů nebo v důsledku definovaných podmínek prostředí, jako je kyselé a / nebo alkalické pH..
Je důležité zmínit, že jakýkoli správně přeložený, složený nebo zabalený protein skrývá jednu nebo více degradačních signálních sekvencí, které jsou „kryptické“ a které lze vystavit, když je protein strukturálně narušen teplotou, pH atd..
Ubikvitinační proteolýza
Ubikvitinace (systém ubikvitin-proteazom) je systém, kterým lze selektivně hydrolyzovat proteiny poté, co jsou specificky označeny pro degradaci, což je proces, který může nastat jak v cytosolu, tak v buněčném jádře.
Tento systém má schopnost rozpoznávat a ničit značené proteiny v jádru a v cytosolu, stejně jako degradovat proteiny, které se během translokace z cytosolu do endoplazmatického retikula neskládají správně..
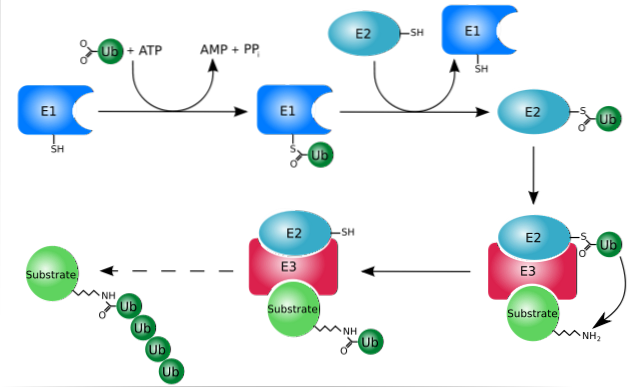
Funguje primárně přidáním nebo konjugací „cílových“ proteinů k malému proteinu nebo peptidu se 76 aminokyselinovými zbytky, lépe známému jako ubikvitin. Tyto „označené“ proteiny ubikvitinací jsou degradovány na malé fragmenty proteasomem 26S, proteázou s více podjednotkami..
Proteolýza autofagií
Autofagie je také některými autory považována za formu proteolýzy, s tím rozdílem, že k ní dochází v uzavřeném membránovém kompartmentu, který je zaměřen na lysosomy (ve zvířecích buňkách), kde proteiny obsažené uvnitř jsou degradovány lysozomálními proteázami.
Neenzymatická proteolýza
Teplota, pH a dokonce i koncentrace solí v médiu mohou způsobit hydrolýzu peptidových vazeb, které drží aminokyseliny různých typů proteinů pohromadě, k čemuž dochází destabilizací a přerušením vazeb..
Funkce
Proteolýza má v živých organismech mnoho funkcí. Zejména to souvisí s obratem bílkovin, přičemž některé specifické proteinové molekuly, které byly přeloženy z jednoho nebo více ribozomů, jsou nakonec degradovány různými rychlostmi..
Bílkoviny mají poločas rozpadu, který se pohybuje od několika sekund do několika měsíců a produkty jejich degradace, ať regulované nebo ne, zprostředkované enzymy nebo ne, se obvykle znovu používají pro syntézu nových proteinů, které pravděpodobně plní různé funkce..
To se děje s bílkovinami konzumovanými v potravinách, které jsou v gastrointestinálním traktu odbourávány proteázami, včetně trypsinu a pepsinu; stejně jako s některými buněčnými proteiny, když buňkám chybí dostatek potravy k přežití.
Intracelulární proteolytické systémy detekují a eliminují „abnormální“ proteiny, které jsou potenciálně toxické pro buňky, protože mohou interagovat s „fyziologicky nevhodnými“ ligandy, navíc k produkci agregátů, které způsobují mechanické a fyzické překážky normálním buněčným procesům..
Akumulace abnormálních bílkovin uvnitř buňky, ať už kvůli poruchám vnitřního proteolytického systému nebo z jiných důvodů, je to, co mnozí vědci považují za jednu z hlavních příčin stárnutí mnohobuněčných živých bytostí..
V imunitním systému
Částečná proteolýza mnoha proteinů z exogenních nebo cizích zdrojů, jako jsou například napadající mikroorganismy, je základním procesem pro systém imunitní odpovědi, protože T lymfocyty rozpoznávají krátké fragmenty, produkt proteolýzy (peptidů), které jsou jim prezentovány. ve spojení se sadou povrchových proteinů.
Tyto peptidy mohou pocházet z ubikvitinačního systému, autofagických procesů nebo nekontrolovaných proteolytických událostí..
Další funkce
Další funkcí omezené nebo částečné proteolýzy je modifikace nově vytvořených proteinů, která funguje jako „přípravek“ pro jejich intra- nebo extracelulární funkce. To platí například pro některé hormony a pro proteiny zapojené do různých metabolických procesů..
Programovaná buněčná smrt (apoptóza) také do značné míry závisí na omezené nebo částečné „místně specifické“ proteolýze intracelulárních proteinů, která je zprostředkována kaskádou specifických proteáz zvaných kaspázy..
Extracelulární regulační systémy také závisí na místně specifické proteolýze a nejvýznamnějším příkladem je koagulace krve..
Obecná nebo úplná proteolýza plní také základní funkce pro selektivní degradaci těch proteinů, jejichž koncentrace musí být pečlivě kontrolována v závislosti na fyziologickém, metabolickém nebo vývoji buněk..
V rostlinách
Rostliny také používají proteolytické procesy k řízení mnoha svých fyziologických a vývojových aspektů. Funguje to například při udržování intracelulárních podmínek a v mechanismech reakce na stresující podmínky, jako je sucho, slanost, teplota atd..
Stejně jako u zvířat, proteolýza v rostlinách spolupracuje na aktivaci a zrání zymogenů (neaktivních proteinů), řídí metabolismus, homeostázu, programované procesy buněčné smrti, vývoj tkání a orgánů atd. U těchto organismů je jednou z nejdůležitějších cesta proteolýzy ubikvitinací.
Reference
- Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M.,… & Walter, P. (2013). Základní buněčná biologie. Věnec věnec.
- Maurizi, M. R. (1992). Proteázy a degradace proteinů v Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, A. (2005). Regulovaná degradace bílkovin. Trends in biochemical sciences, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteolýza v rostlinách: mechanismy a funkce. In Post-transkripční kontrola genové exprese v rostlinách (str. 275-302). Springer, Dordrecht.
- Wolf, D. H. a Menssen, R. (2018). Mechanismy buněčné regulace-proteolýzy, velké překvapení. FEBS dopisy, 592 (15), 2515-2524.


Zatím žádné komentáře