
Co je elektronová hustota?
The elektronová hustota je měřítkem toho, jak je pravděpodobné, že najde elektron v dané oblasti vesmíru; buď kolem atomového jádra, nebo v „sousedství“ v molekulárních strukturách.
Čím vyšší je koncentrace elektronů v daném bodě, tím vyšší je elektronová hustota, a proto se bude odlišovat od svého okolí a bude vykazovat určité vlastnosti, které vysvětlují chemickou reaktivitu. Vynikající a grafický způsob, jak představit takový koncept, je prostřednictvím mapa elektrostatického potenciálu.

Například horní obrázek ukazuje strukturu enantiomeru S-karnitinu s odpovídající mapou elektrostatického potenciálu. Lze pozorovat stupnici složenou z barev duhy: červená pro označení oblasti s nejvyšší hustotou elektronů a modrá pro tuto oblast, která je chudá na elektrony..
Jak se molekula prochází zleva doprava, vzdalujeme se od skupiny -COdva- směrem ke kostře CHdva-CHOH-CHdva, kde barvy jsou žluté a zelené, což naznačuje pokles hustoty elektronů; až do skupiny -N (CH3)3+, nejchudší oblast elektronů, zbarvená modře.
Obecně jsou oblasti, kde je hustota elektronů nízká (ty zbarvené žlutě a zeleně), nejméně reaktivní v molekule..
Rejstřík článků
- 1 Koncept
- 2 Mapa elektrostatického potenciálu
- 2.1 Porovnání barev
- 2.2 Chemická reaktivita
- 3 Hustota elektronů v atomu
- 4 Odkazy
Pojem
Hustota elektronů je více než chemická a má fyzikální povahu, protože elektrony nezůstávají statické, ale putují z jedné strany na druhou a vytvářejí elektrická pole..
A variace těchto polí způsobují rozdíly v hustotách elektronů na van der Waalsových plochách (všechny tyto povrchy koulí).
Strukturu S-karnitinu představuje model koulí a tyčí, ale pokud by to byl jeho povrch van der Waals, tyče by zmizely a byla by pozorována pouze upečená sada koulí (se stejnými barvami).
Elektrony jsou pravděpodobněji kolem více elektronegativních atomů; v molekulární struktuře však může být více než jeden elektronegativní atom, a proto skupiny atomů, které také uplatňují svůj vlastní indukční účinek.
To znamená, že elektrické pole se mění více, než lze předvídat pozorováním molekuly z ptačí perspektivy; to znamená, že může dojít k větší či menší polarizaci záporných nábojů nebo elektronové hustoty.
To lze také vysvětlit následovně: rozložení zatížení se stává homogennějším.
Mapa elektrostatického potenciálu
Například protože -OH skupina má atom kyslíku, přitahuje elektronovou hustotu sousedních atomů; v S-karnitinu však poskytuje část své elektronové hustoty skupině -COdva-, zároveň opustit skupinu -N (CH3)3+ s větším elektronickým nedostatkem.
Všimněte si, že může být velmi obtížné odvodit, jak indukční účinky fungují ve složité molekule, jako je například protein..
Abychom měli po ruce přehled těchto rozdílů v elektrických polích ve struktuře, používá se výpočetní výpočet map elektrostatického potenciálu..
Tyto výpočty spočívají v umístění kladného bodového náboje a jeho pohybu po povrchu molekuly; tam, kde je menší hustota elektronů, dojde k elektrostatickému odpuzování a čím vyšší bude odpuzování, tím intenzivnější bude modrá barva.
Tam, kde je elektronová hustota vyšší, bude existovat silná elektrostatická přitažlivost, představovaná červenou barvou.
Výpočty zohledňují všechny strukturální aspekty, dipólové momenty vazeb, indukční účinky způsobené všemi vysoce elektronegativními atomy atd. Výsledkem jsou barevné a vizuálně atraktivní povrchy..
Porovnání barev
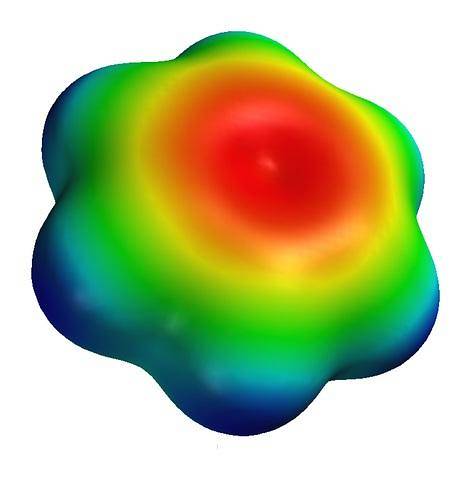
Nahoře je mapa elektrostatického potenciálu pro molekulu benzenu. Všimněte si, že ve středu prstence je vyšší hustota elektronů, zatímco jeho „špičky“ jsou namodralé, kvůli méně elektronegativním atomům vodíku. Podobně je toto rozložení nábojů způsobeno aromatickým charakterem benzenu.
Na této mapě jsou také pozorovány zelené a žluté barvy, což naznačuje přiblížení regionům chudým a bohatým na elektrony..
Tyto barvy mají svou vlastní stupnici odlišnou od barvy S-karnitinu; a proto je nesprávné porovnávat skupinu -COdva- a střed aromatického kruhu, oba představovaní červenou barvou na jejich mapách.
Pokud by si oba ponechali stejnou barevnou stupnici, bylo by vidět, že červená barva na benzenové mapě bude slabě oranžová. Podle této standardizace lze srovnávat mapy elektrostatického potenciálu, a tím i hustoty elektronů různých molekul..
Jinak by mapa sloužila pouze k poznání distribucí nábojů pro jednotlivé molekuly..
Chemická reaktivita
Pozorováním mapy elektrostatického potenciálu, a tedy oblastí s vysokou a nízkou hustotou elektronů, lze předpovědět (i když ne ve všech případech), kde v molekulární struktuře dojde k chemickým reakcím..
Regiony s vysokou hustotou elektronů jsou schopné „poskytnout“ své elektrony okolním druhům, které to potřebují nebo potřebují; těmto druhům, záporně nabitým, E.+, jsou známí jako elektrofily.
Proto mohou elektrofily reagovat se skupinami představovanými červenou barvou (-COdva- a střed benzenového kruhu).
Zatímco oblasti s nízkou hustotou elektronů reagují se záporně nabitými druhy nebo s těmi, které mají volné páry elektronů ke sdílení; druhé jsou známé jako nukleofily.
V případě -N (CH3)3+, bude reagovat tak, že atom dusíku získává elektrony (snižuje).
Hustota elektronů v atomu
V atomu se elektrony pohybují obrovskou rychlostí a mohou být současně v několika oblastech vesmíru.
Jak se však vzdálenost od jádra zvětšuje, elektrony získávají elektronickou potenciální energii a jejich pravděpodobnostní distribuce klesá..
To znamená, že elektronická mračna atomu nemají definovanou hranici, ale rozmazanou. Proto není snadné vypočítat atomový poloměr; Pokud neexistují sousedé, kteří určují rozdíl ve vzdálenostech svých jader, z nichž polovinu lze považovat za atomový poloměr (r = d / 2).
Atomové orbitaly a jejich funkce radiálních a úhlových vln ukazují, jak se mění hustota elektronů jako funkce vzdálenosti, která je odděluje od jádra..
Reference
- Reed College. (s.f.). Co je elektronová hustota? ROCO. Obnoveno z: reed.edu
- Wikipedia. (2018). Hustota elektronů. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11. června 2014). Definice elektronové hustoty. Obnoveno z: thoughtco.com
- Steven A. Hardinger. (2017). Ilustrovaný glosář organické chemie: elektronová hustota. Obnoveno z: chem.ucla.edu
- Chemistry LibreTexts. (29. listopadu 2018). Atomové velikosti a rozdělení elektronové hustoty. Obnoveno z: chem.libretexts.org
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.



Zatím žádné komentáře