
Co jsou zdegenerované orbitaly?
The zdegenerované orbitaly jsou to všichni ti, kteří jsou na stejné energetické úrovni. Podle této definice musí mít stejné hlavní kvantové číslo n. Orbitály 2s a 2p jsou tedy zdegenerované, protože patří do energetické úrovně 2. Je však známo, že jejich funkce úhlové a radiální vlny jsou odlišné.
Jako hodnoty n, elektrony začnou zabírat další energetické úrovně, jako jsou orbitály d a f. Každý z těchto orbitalů má své vlastní charakteristiky, které lze na první pohled vidět v jejich hranatých tvarech; Jedná se o sférické (s), činkové (p), čtyřlístkové (d) a kulové (f) postavy.
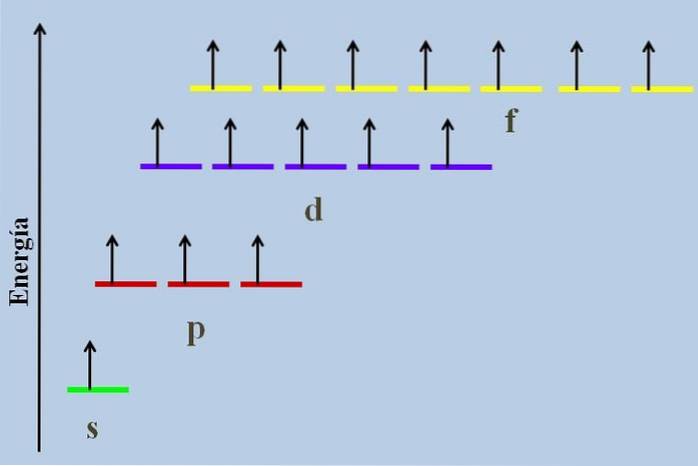
Mezi nimi je energetický rozdíl, i když patří do stejné úrovně n.
Například výše uvedený obrázek ukazuje energetické schéma s orbitaly obsazenými nepárovými elektrony (neobvyklý případ). Je vidět, že ze všech nejstabilnějších (ten s nejnižší energií) je orbitální ns (1s, 2s, ...), zatímco nf je nejstabilnější (ten s nejvyšší energií).
Rejstřík článků
- 1 Degenerované orbitaly izolovaného atomu
- 1.1 Orbitály str
- 1.2 Orbitály d
- 1.3 Orbitály f
- 2 degenerované hybridní orbitaly
- 3 Odkazy
Degenerované orbitaly izolovaného atomu
Degenerované orbitaly se stejnou hodnotou n, jsou na stejné lince v energetickém schématu. Z tohoto důvodu jsou tři červené pruhy, které symbolizují p orbitaly, umístěny na stejné linii; stejně jako fialové a žluté pruhy stejným způsobem.
Schéma na obrázku porušuje Hundovo pravidlo: orbitály s vyšší energií jsou naplněny elektrony, aniž by je nejprve spárovaly s nízkoenergetickými. Jak se elektrony páří, orbitál ztrácí energii a vyvíjí větší elektrostatický odpor na nepárové elektrony ostatních orbitalů..
V mnoha energetických diagramech však tyto účinky nejsou zohledněny. Pokud ano, a poslouchat Hundovu vládu bez úplného naplnění d orbitalů, bylo by vidět, že přestávají být zvrhlí.
Jak již bylo zmíněno dříve, každý orbitál má své vlastní vlastnosti. Izolovaný atom má ve své elektronické konfiguraci své elektrony uspořádané v přesném počtu orbitalů, aby se do nich vešly. Pouze zvrhlíky lze považovat za zvrhlé.
Orbitály str
Tři červené pruhy pro zdegenerované p orbitaly na obrázku ukazují, že oba pX, pY A strz mají stejnou energii. V každém je nepárový elektron popsaný čtyřmi kvantovými čísly (n, l, ml Y slečna), zatímco první tři popisují orbitaly.
Jediný rozdíl mezi nimi je označen magnetickým momentem ml, který kreslí cestu pX na ose x, strY na ose ya strz na ose z. Všechny tři jsou stejné, ale liší se pouze svou prostorovou orientací. Z tohoto důvodu jsou vždy nakresleny vyrovnány v energii, to znamená degenerované.
Jelikož jsou stejné, izolovaný atom dusíku (s konfigurací 1 sdva2 sdva2 str3) musí udržovat své tři p orbitaly zdegenerované. Energetický scénář se však náhle změní, pokud vezmeme v úvahu atom dusíku v molekule nebo chemické sloučenině..
Proč? Protože i když pX, pY A strz mají stejnou energii, což se může lišit u každého z nich, pokud mají odlišné chemické prostředí; to znamená, pokud se vážou na různé atomy.
Orbitály d
Existuje pět fialových pruhů, které označují d orbitalů. V izolovaném atomu, i když mají spárované elektrony, je těchto pět orbitalů považováno za degenerované. Na rozdíl od orbitálů p však tentokrát existuje výrazný rozdíl v jejich úhlových tvarech.
Proto jeho elektrony procházejí směry ve vesmíru, které se liší od jedné d orbitální k druhé. To způsobuje, podle teorie krystalového pole, že minimální narušení způsobuje a rozdělení energie orbitalů; to znamená, že se pět fialových pruhů oddělí, takže mezi nimi zůstane energetická mezera:
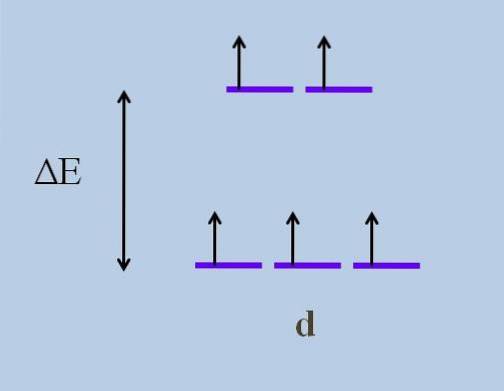
Co jsou horní orbitaly a jaké jsou spodní orbitaly? Výše uvedené jsou symbolizovány jako aG, a ti níže t2 g. Všimněte si, jak byly původně zarovnány všechny fialové pruhy a nyní byla vytvořena sada dvou orbitalů aG energičtější než druhá sada tří orbitalů t2 g.
Tato teorie nám umožňuje vysvětlit přechody d-d, kterým se připisuje mnoho barev pozorovaných ve sloučeninách přechodných kovů (Cr, Mn, Fe atd.). A co je příčinou tohoto elektronického rušení? Ke koordinačním interakcím kovového centra s jinými molekulami tzv ligandy.
Orbitály f
A s f orbitály, plstěnými žlutými pruhy, se situace ještě komplikuje. Jejich prostorové směry se mezi nimi hodně liší a zobrazení jejich odkazů se stává příliš složitým.
Ve skutečnosti jsou orbitaly považovány za tak vnitřně opláštěné, že se „nezúčastňují znatelně“ na tvorbě vazeb..
Když se izolovaný atom s f orbitaly obklopí dalšími atomy, začnou interakce a rozvíjí se (ztráta degenerace):
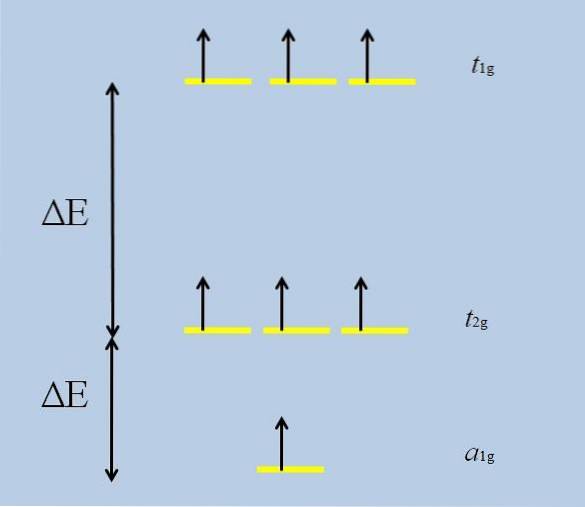
Všimněte si, že nyní žluté pruhy tvoří tři sady: t1 g, t2 g Y na1 g, a že již nedegenerují.
Degenerované hybridní orbitaly
Bylo vidět, že orbitaly se mohou rozvinout a ztratit degeneraci. I když to vysvětluje elektronické přechody, zbledne to při objasňování toho, jak a proč existují různé molekulární geometrie. Tady přicházejí hybridní orbitaly..
Jaké jsou jeho hlavní vlastnosti? Že jsou zdegenerovaní. Vznikají tedy ze směsi znaků orbitalů s, p, d a f, aby vznikly degenerované hybridy.
Například tři orbitaly p se smíchají s jedním s, čímž vzniknou čtyři sp orbitaly3. Všechny sp orbitaly3 jsou zdegenerovaní, a proto mají stejnou energii.
Pokud jsou navíc smíchány dva d orbitaly se čtyřmi sp3, dostanete šest sp orbitalů3ddva.
A jak vysvětlují molekulární geometrie? Protože jich je šest, se stejnými energiemi, musí být proto orientovány symetricky v prostoru, aby generovaly stejné chemické prostředí (například ve sloučenině MF6).
Když tak učiní, vytvoří se koordinační osmistěn, který se rovná oktaedrické geometrii kolem středu (M).
Geometrie jsou však často zkreslené, což znamená, že ani hybridní orbitaly nejsou skutečně úplně zdegenerované. Na závěr tedy degenerované orbitaly existují pouze v izolovaných atomech nebo ve vysoce symetrických prostředích..
Reference
- Slovník Chemicool. (2017). Definice Degenerate. Obnoveno z: chemicool.com
- SparkNotes LLC. (2018). Atomy a atomové orbitaly. Obnoveno z: sparknotes.com
- Čistá chemie. (s.f.). Elektronická konfigurace. Obnoveno z: es-puraquimica.weebly.com
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Moreno R. Esparza. (2009). Kurz koordinační chemie: Pole a orbitaly. [PDF]. Obnoveno z: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.



Zatím žádné komentáře