
Atomový poloměr, jak se měří, jak se mění a příklady
The atomové rádio je to důležitý parametr pro periodické vlastnosti prvků periodické tabulky. To přímo souvisí s velikostí atomů, protože čím větší je poloměr, tím větší nebo objemnější jsou. Podobně to souvisí s jejich elektronickými charakteristikami..
Čím více elektronů má atom, tím větší je jeho atomová velikost a poloměr. Oba jsou definovány elektrony valenčního pláště, protože ve vzdálenostech za jejich oběžnými drahami se pravděpodobnost nalezení elektronu blíží nule. V blízkosti jádra nastává opak: pravděpodobnost nalezení elektronu se zvyšuje.

Horní obrázek představuje balíček bavlněných kuliček. Všimněte si, že každý z nich je obklopen šesti sousedy, nepočítaje další možný horní nebo dolní řádek. Způsob, jakým jsou bavlněné kuličky stlačeny, určí jejich velikosti, a tedy i jejich poloměry; stejně jako atomy.
Prvky podle své chemické povahy tak či onak interagují se svými vlastními atomy. V důsledku toho se velikost atomového poloměru mění podle typu přítomné vazby a pevného balení jejích atomů..
Rejstřík článků
- 1 Jak se měří atomový poloměr?
- 1.1 Stanovení mezijaderné vzdálenosti
- 1.2 Jednotky
- 2 Jak se to mění v periodické tabulce?
- 2.1 Za určité období
- 2.2 Sestup přes skupinu
- 2.3 Kontrakce lanthanoidů
- 3 příklady
- 4 Odkazy
Jak změříte atomový poloměr?
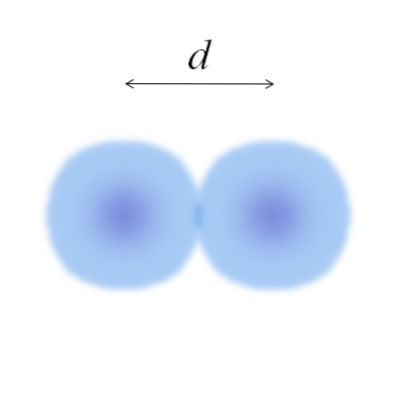
Na hlavním obrázku může být snadné změřit průměr vatových koulí a poté je rozdělit na dva. Sféra atomu však není plně definována. Proč? Protože elektrony cirkulují a difundují ve specifických oblastech vesmíru: na orbitálech.
Atom lze proto považovat za kouli s nehmatatelnými hranami, což nelze s jistotou říci, jak daleko končí. Například na obrázku výše oblast středu, blízko jádra, zobrazuje intenzivnější barvu, zatímco její okraje jsou rozmazané..
Obrázek představuje rozsivkovou molekulu E.dva (jako Cldva, Hdva, NEBOdva, atd.). Za předpokladu, že atomy jsou sférická tělesa, pokud by byla určena vzdálenost d která odděluje obě jádra v kovalentní vazbě, stačilo by ji rozdělit na dvě poloviny (d/ 2) získat atomový poloměr; přesněji kovalentní poloměr E až Edva.
Co kdyby E netvořil kovalentní vazby sám se sebou, ale byl to kovový prvek? Pak d bylo by to indikováno počtem sousedů, kteří obklopují E v jeho kovové struktuře; tj. podle koordinačního čísla (N.C) atomu uvnitř obalu (pamatujte na bavlněné kuličky na hlavním obrázku).
Stanovení mezijaderné vzdálenosti
Určit d, což je internukleární vzdálenost pro dva atomy v molekule nebo obalu, jsou vyžadovány techniky fyzikální analýzy.
Jednou z nejpoužívanějších je rentgenová difrakce, v níž se paprsek světla ozařuje krystalem a studuje se difrakční obrazec vznikající z interakcí mezi elektrony a elektromagnetickým zářením. V závislosti na obalu lze získat různé difrakční vzory, a proto i další hodnoty d.
Pokud jsou atomy v krystalové mřížce „těsné“, budou mít různé hodnoty d ve srovnání s tím, co by měli, kdyby byli „v pohodě“. Podobně tyto mezijaderné vzdálenosti mohly kolísat v hodnotách, takže atomový poloměr ve skutečnosti sestává z průměrné hodnoty těchto měření..
Jak souvisí atomový poloměr a koordinační číslo? V. Goldschmidt vytvořil vztah mezi těmito dvěma, ve kterém pro N.C 12 je relativní hodnota 1; 0,97 pro náplň, kde atom má N.C rovný 8; 0,96, pro N.C rovné 6; a 0,88 pro N.C 4.
Jednotky
Z hodnot pro N.C rovných 12 bylo zkonstruováno mnoho tabulek, kde jsou porovnávány atomové poloměry všech prvků periodické tabulky.
Protože ne všechny prvky tvoří takové kompaktní struktury (N.C menší než 12), používá se k výpočtu jejich atomových poloměrů a jejich vyjádření pro stejný obal vztah V. Goldschmidt. Tímto způsobem jsou standardizována měření atomových poloměrů..
Ale v jakých jednotkách jsou vyjádřeny? Vzhledem k d je velmi malé velikosti, musíme se uchýlit k angstromovým jednotkám Å (10 ∙ 10-10m) nebo také široce používaný pikometr (10 ∙ 10-12m).
Jak se to mění v periodické tabulce?
Po dobu
Atomové poloměry určené pro kovové prvky se nazývají kovové poloměry, zatímco pro nekovové prvky jsou kovalentní poloměry (například fosfor, P4, nebo síra, S8). Mezi těmito dvěma typy paprsků však existuje výraznější rozdíl než u názvu.
Zleva doprava ve stejném období jádro přidává protony a elektrony, ale ty jsou omezeny na stejnou energetickou hladinu (hlavní kvantové číslo). V důsledku toho jádro vyvíjí rostoucí účinný jaderný náboj na valenční elektrony, který stahuje atomový poloměr..
Tímto způsobem mají nekovové prvky ve stejném období tendenci mít menší atomové (kovalentní) poloměry než kovy (kovové poloměry).
Sestup přes skupinu
Při sestupu skupinou se aktivují nové energetické úrovně, které umožňují elektronům mít více prostoru. Elektronický mrak tedy pokrývá větší vzdálenosti, jeho rozmazaná periferie se nakonec pohybuje dále od jádra, a proto se atomový poloměr rozšiřuje..
Lanthanidová kontrakce
Elektrony ve vnitřním obalu pomáhají chránit efektivní jaderný náboj na valenčních elektronech. Když mají orbitaly, které tvoří vnitřní vrstvy, mnoho „děr“ (uzlů), jak se to děje u f orbitalů, jádro kvůli jejich špatnému stínícímu účinku silně kontrahuje poloměr atomu..
Tato skutečnost je doložena kontrakcí lanthanoidu v období 6 periodické tabulky. Z La do Hf dochází ke značnému zmenšení poloměru atomu v důsledku f orbitalů, které se „zaplňují“ při procházení f bloku: lanthanoidů a aktinoidů.
Podobný účinek lze pozorovat také u prvků bloku p z období 4. Tentokrát produkt slabého stínícího účinku d orbitalů, které se naplní při průchodu periodami přechodového kovu.
Příklady
Pro období 2 periodické tabulky jsou atomové poloměry jeho prvků:
-Li: 257 hodin
-Be: 112 pm
-B: 88 hodin
-C: 77 hodin
-N: 74 hodin
-Nebo: 66 hodin
-F: 64 hodin
Všimněte si, že lithiový kov má největší atomový poloměr (257 pm), zatímco fluor, který se nachází v krajní pravé části období, je nejmenší ze všech (64 pm). Atomový poloměr klesá ve stejném období zleva doprava a uvedené hodnoty to ukazují.
Lithium, když tvoří kovové vazby, jeho poloměr je kovový; a fluor, protože tvoří kovalentní vazby (F-F), jeho poloměr je kovalentní.
Co když chcete vyjádřit atomové poloměry v jednotkách angstromu? Jednoduše je vydělte 100: (257/100) = 2,57Å. A tak dále se zbytkem hodnot.
Reference
- Chemistry 301. Atomic Radii. Obnoveno z: ch301.cm.utexas.edu
- Nadace CK-12. (28. června 2016). Atomový poloměr. Obnoveno z: chem.libretexts.org
- Trendy v atomových poloměrech. Převzato z: intro.chem.okstate.edu
- Clackamas Community College. (2002). Atomová velikost. Obnoveno z: dl.clackamas.edu
- Clark J. (srpen 2012). Atomový a iontový poloměr. Obnoveno z: chemguide.co.uk
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., S. 23, 24, 80, 169). Mc Graw Hill.



Zatím žádné komentáře