
Typy a příklady reakcí s dvojitou substitucí

The dvojitá substituční reakce, dvojité vytěsnění nebo metathéza, je metoda, při které dochází k dvojité iontové výměně mezi dvěma sloučeninami, aniž by některá z nich byla oxidována nebo redukována. Představuje jednu z nejzákladnějších chemických reakcí.
Nové vazby jsou tvořeny velkými elektrostatickými přitažlivými silami mezi ionty. Podobně reakce upřednostňuje tvorbu nejstabilnějších druhů, zejména molekuly vody. Obrázek níže ilustruje obecnou chemickou rovnici pro reakci s dvojitou substitucí..
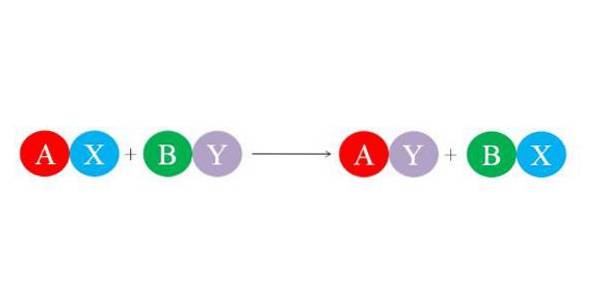
Počáteční sloučeniny AX a BY reagují výměnou „svých partnerů“ a tvoří tak dvě nové sloučeniny: AY a BX. K této reakci dochází tehdy a jen tehdy, jsou-li A a Y více příbuzné než A a B, nebo pokud jsou vazby BX stabilnější než vazby BY. Protože reakce je jednoduchá iontová výměna, žádný iont nezískává ani neztrácí elektrony (redoxní reakce).
Pokud je tedy A kation s nábojem +1 ve sloučenině AX, bude mít stejný náboj +1 ve sloučenině AY. Totéž platí pro ostatní „písmena“. Tento typ reakce je podporou acidobazických reakcí a tvorbou sraženin..
Rejstřík článků
- 1 typů
- 1.1 Neutralizace
- 1.2 Srážky
- 2 Příklady
- 2.1 Příklad 1
- 2.2 Příklad 2
- 2.3 Příklad 3
- 2.4 Příklad 4
- 2.5 Příklad 5
- 2.6 Příklad 6
- 2.7 Příklad 7
- 2.8 Příklad 8
- 3 Odkazy
Typy
Neutralizace
Silná kyselina reaguje se silnou bází za vzniku rozpustných solí a vody. Když je jedna ze dvou látek - kyselina nebo báze - slabá, vyrobená sůl není zcela ionizovaná; tj. ve vodném médiu schopném hydrolýzy. Podobně lze kyselinu nebo bázi neutralizovat solí..
Výše uvedené lze opět představovat chemickou rovnicí s písmeny AXBY. Protože je však Brønstedova kyselost indikována pouze H ionty+ a OH-, Ty pak přicházejí reprezentovat písmena A a Y:
HX + BOH => HOH + BX
Tato chemická rovnice odpovídá neutralizaci, což je jednoduše reakce mezi kyselinou HX a bází BOH za vzniku HOH (HdvaO) a BX sůl, která může nebo nemusí být rozpustná ve vodě.
Jeho kostra se může lišit podle stechiometrických koeficientů nebo povahy kyseliny (pokud je organická nebo anorganická).
Srážky
Při tomto typu reakce je jeden z produktů nerozpustný v médiu, obvykle vodný, a sráží (pevná látka se usazuje ze zbytku roztoku).
Schéma je následující: dvě rozpustné sloučeniny, AX a BY, jsou smíchány a jeden z produktů, AY nebo BX, se vysráží, což bude záviset na pravidlech rozpustnosti:
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
V případě, že jsou AY i BX nerozpustné ve vodě, vysráží se dvojice iontů, které vykazují nejsilnější elektrostatické interakce, což se může kvantitativně projevit v jejich hodnotách konstant rozpustnosti (Kps).
Ve většině srážecích reakcí je však jedna sůl rozpustná a druhá sráží. Obě reakce - neutralizace i srážení - mohou nastat ve stejné směsi látek.
Příklady
Příklad 1
HCl (vodný) + NaOH (vodný) => HdvaO (l) + NaCl (vod.)
Co je to za reakci? Kyselina chlorovodíková reaguje s hydroxidem sodným a v důsledku toho vytváří vodu a chlorid sodný. Vzhledem k tomu, že NaCl je velmi rozpustný ve vodném prostředí a že se také vytvořila molekula vody, je reakce z příkladu 1 neutralizační.
Příklad 2
Razítko3)dva(ac) + NadvaS (ac) => CuS (s) + 2NaNO3(ac)
Ani H iont není v této reakci přítomen+ ani OH-, a ani molekula vody není pozorována na pravé straně chemické rovnice.
Dusičnan měďnatý nebo dusičnan měďnatý vyměňuje ionty se sirníkem sodným. Sulfid měďnatý je nerozpustný, sráží se na rozdíl od rozpustné soli dusičnanu sodného.
Roztok Cu (č3)dva je namodralý, zatímco NadvaS je nažloutlý. Když jsou obě smíchány, barvy zmizí a vysráží se CuS, což je načernalá pevná látka..
Příklad 3
CH3COOH (vodný) + NaOH (vodný) => CH3COONa (ac) + HdvaO (l)
Opět se jedná o další neutralizační reakci. Kyselina octová reaguje s hydroxidem sodným za vzniku octanu sodného a molekuly vody.
Na rozdíl od příkladu 1 není octan sodný solí, která je plně ionizovaná, protože anion je hydrolyzován:
CH3VRKAT-(ac) + HdvaO (l) <=> CH3COOH (vodný) + OH-(ac)
Příklad 4
2HI (ac) + CaCO3(s) => HdvaCO3(ac) + CaIdva(ac)
V této reakci - která, i když se nezdá, že je neutralizační - kyselina jodovodíková reaguje úplně s vápencem za vzniku kyseliny uhličité a jodidu vápenatého. Kromě toho vývoj tepla (exotermická reakce) rozkládá kyselinu uhličitou na oxid uhličitý a vodu:
HdvaCO3(ac) => COdva(g) + HdvaO (l)
Celková reakce je následující:
2HI (ac) + CaCO3(s) => COdva(g) + HdvaO (l) + CaIdva(ac)
Rovněž uhličitan vápenatý, zásaditá sůl, neutralizuje kyselinu jodovodíkovou.
Příklad 5
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
Dusičnan stříbrný si vyměňuje ionty s chloridem sodným, čímž vytváří nerozpustnou sůl chlorid stříbrný (bělavá sraženina) a dusičnan sodný..
Příklad 6
2H3PO4(ac) + 3Ca (OH)dva(ac) => 6HdvaO (l) + Ca3(PO4)dva(s)
Kyselina fosforečná je neutralizována hydroxidem vápenatým, čímž vzniká nerozpustná sůl fosforečnan vápenatý a šest molů molekul vody..
Toto je příklad dvojité substituční reakce obou typů: neutralizace kyseliny a vysrážení nerozpustné soli..
Příklad 7
K.dvaS (ac) + MgSO4(ac) => K.dvaSW4(ac) + MgS (y)
Sulfid draselný reaguje se síranem hořečnatým a sbírá ionty S v roztokudva- a Mgdva+ za vzniku nerozpustné soli sulfidu hořečnatého a rozpustné soli síranu draselného.
Příklad 8
NadvaS (aq) + HCl (aq) → NaCl (aq) + HdvaS (g)
Sulfid sodný neutralizuje kyselinu chlorovodíkovou za vzniku chloridu sodného a sirovodíku.
Při této reakci se netvoří voda (na rozdíl od nejběžnějších neutralizací), ale neelektrolytická molekula sirovodík, jejíž zápach po shnilých vejcích je velmi nepříjemný. HdvaS uniká z roztoku v plynné formě a zbytek druhů zůstává rozpuštěn.
Reference
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 150-155.
- Quimicas.net (2018). Příklady reakce s dvojitou substitucí. Citováno 28. května 2018 z: quimicas.net
- Metathesis Reactions. Citováno 28. května 2018 z: science.uwaterloo.ca
- Khan Academy. (2018). Dvojité náhradní reakce. Citováno 28. května 2018 z: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8. května 2016). Definice reakce dvojité náhrady. Citováno 28. května 2018 z: thoughtco.com



Zatím žádné komentáře