
Historie selenu, vlastnosti, struktura, získávání, použití
The selen Jedná se o nekovový chemický prvek, který patří do skupiny 16 periodické tabulky a je reprezentován symbolem Se. Tento prvek má střední vlastnosti mezi sírou a telurem, které jsou členy stejné skupiny.
Selen objevili v roce 1817 Jöhs J. Berzelius a John G. Gahn, kteří při odpařování pyritu pozorovali červený zbytek (spodní obrázek). Nejprve si to pletli s telurem, ale pak si uvědomili, že mají co do činění s novým prvkem.

Berzelius pojmenoval nový prvek selen na základě jména „selen“, což znamená „bohyně měsíce“. Selen je nezbytným stopovým prvkem pro rostliny a zvířata, i když ve vysokých koncentracích je toxickým prvkem.
Selen má tři hlavní alotropní formy: červenou, černou a šedou. Ten druhý má tu vlastnost, že mění svou elektrickou vodivost v závislosti na intenzitě světla, které ho vyzařuje (fotovodič), pro které má mnoho aplikací.
Selen je široce distribuován v zemské kůře, avšak minerály, které jej obsahují, nejsou hojné, takže nedochází k těžbě selenu.
Získává se hlavně jako vedlejší produkt procesu rafinace elektrolýzou mědi. Selen se hromadí v bahně nacházejícím se na anodě elektrolýzních článků.
Lidské bytosti vlastní kolem 25 selenoproteinů, z nichž některé mají antioxidační účinek a řídí tvorbu volných radikálů. Existují také aminokyseliny selenu, jako je selenomethionin a selenocystein.
Rejstřík článků
- 1 Historie
- 1.1 První pozorování
- 1.2 Objev
- 1.3 Původ jeho jména
- 1.4 Vývoj vašich aplikací
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Standardní atomová hmotnost
- 2.3 Atomové číslo (Z)
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Fúzní teplo
- 2.8 Odpařovací teplo
- 2.9 Molární tepelná kapacita
- 2.10 oxidační čísla
- 2.11 Elektronegativita
- 2.12 Ionizační energie
- 2.13 Magnetický řád
- 2.14 Tvrdost
- 2.15 Izotopy
- 2.16 Allotropy
- 3 Reaktivita
- 3.1 Reakce s vodíkem
- 3.2 Reakce s kyslíkem
- 3.3 Reakce s halogeny
- 3.4 Reakce s kovy
- 3.5 Selenity
- 3.6 Kyseliny
- 4 Struktura a elektronická konfigurace
- 4.1 - Selen a jeho vazby
- 4.2 - Prsteny nebo řetězy
- 4.3 - Allotropes
- 5 Kde najít a vyrobit
- 5.1 Elektrolýza mědi
- 6 Biologická role
- 6.1 Nedostatek
- 6.2 Enzymový kofaktor
- 6.3 Proteiny a aminokyseliny
- 7 Rizika
- 8 použití
- 8.1 Kosmetika
- 8.2 Lékaři
- 8.3 Elektrolýza manganu
- 8.4 Pigment
- 8.5 Fotovodič
- 8.6 Krystaly
- 8.7 Vulkanizace
- 8.8 Slitiny
- 8.9 Usměrňovače
- 9 Odkazy
Příběh
První pozorování
Alchymista Arnold de Villanova mohl pozorovat selen v roce 1230. Vyučil se v medicíně na pařížské Sorbonně a byl dokonce doktorem papeže Klementa V..
Villanova ve své knize Rosarium Philosophorum popisuje červenou síru nebo „sirné rebeum“, které zůstalo v peci po odpaření síry. Tato červená síra mohla být alotropem selenu.
Objev
V roce 1817 objevili Jöhs Jakob Berzelius a John Gottlieb Gahn selen v chemickém závodu na výrobu kyseliny sírové poblíž Gripsholmu ve Švédsku. Surovinou pro výrobu kyseliny byl pyrit, který byl extrahován z dolu Falun..
Berzelius byl zasažen existencí červeného zbytku, který zůstal v hlavní nádobě po spálení síry.
Berzelius a Gahn také zjistili, že červený zbytek má silnou vůni křenu, podobnou vůni teluru. Proto napsal svému příteli Marectovi, že věří, že pozorovaný vklad je sloučeninou telluru..
Berselius však pokračoval v analýze usazeného materiálu při spalování pyritu a znovu zvážil, že v dole Falun nebyl nalezen telur. V únoru 1818 došel k závěru, že objevil nový prvek.
Původ jeho názvu
Berzelius poukázal na to, že nový prvek byl kombinací síry a teluru a že podobnost teluru s novým prvkem mu dala příležitost pojmenovat novou látku selen..
Berzelius vysvětlil, že „tellus“ znamená bohyni Země. Martin Klaport v roce 1799 dal toto jméno teluru a napsal: „Žádný jediný prvek se tak nenazývá. Muselo se to udělat! “.
Kvůli podobnosti teluru s novou látkou jej Berzelius pojmenoval slovem selen, odvozeným z řeckého slova „selen“, což znamená „bohyně měsíce“..
Vývoj vašich aplikací
V roce 1873 Willoughby Smith objevil, že elektrická vodivost selenu závisí na světle, které jej vyzařuje. Tato vlastnost umožnila selenu mít mnoho aplikací.
Alexander Graham Bell v roce 1979 použil ve svém fotofonu selen. Selen produkuje elektrický proud úměrný intenzitě světla, které jej osvětluje, používá se ve světelných metrech, bezpečnostních mechanismech pro otevírání a zavírání dveří atd..
Použití selenových usměrňovačů v elektronice začalo ve třicátých letech minulého století s řadou komerčních aplikací. V 70. letech byl v usměrňovačích nahrazen křemíkem.
V roce 1957 bylo zjištěno, že selen byl nezbytným prvkem pro život savců, protože byl přítomen v enzymech, které chrání před reaktivním kyslíkem a volnými radikály. Kromě toho byla objevena existence aminokyselin, jako je selenomethionin.
Fyzikální a chemické vlastnosti
Vzhled
Jelikož existuje několik alotropů pro selen, liší se jeho fyzický vzhled. Obvykle se vyskytuje ve formě načervenalé pevné látky ve formě prášku.
Standardní atomová hmotnost
78 971 u
Atomové číslo (Z)
3. 4
Bod tání
221 ° C
Bod varu
685 ° C
Hustota
Hustota selenu se liší v závislosti na tom, jaký alotrop nebo polymorf je považován. Některé jeho hustoty stanovené při pokojové teplotě jsou:
Šedá: 4,819 g / cm3
Alfa: 4,39 g / cm3
Sklovec: 4,28 g / cm3
Kapalný stav (bod tání): 3,99 g / cm3
Teplo fúze
Šedá: 6,69 kJ / mol
Odpařovací teplo
95,48 kJ / mol
Molární tepelná kapacita
25,363 J / (mol K)
Oxidační čísla
Selen se může ve svých sloučeninách vázat a projevovat následující počty nebo oxidační stavy: -2, -1, +1, +2, +3, +4, +5, +6. Mezi všemi jsou nejdůležitější -2 (Sedva-), +4 (Se4+) a +6 (viz6+).
Například v SeOdva selen má oxidační číslo +4; to znamená, že se předpokládá existence kationtu Se4+ (Vím4+NEBOdvadva-). Podobně se SeO3 selen má oxidační číslo +6 (viz6+NEBO3dva-).
V selenidu vodíku HdvaSe, selen má oxidační číslo -2; to znamená, opět se předpokládá existence iontu nebo aniontu Sedva- (Hdva+vímdva-). Je tomu tak proto, že selen je více elektronegativní než vodík..
Elektronegativita
2,55 na Paulingově stupnici.
Ionizační energie
-První: 941 kJ / mol.
-Za druhé: 2 045 kJ / mol.
-Za třetí: 2 973,7 kJ / mol.
Magnetický řád
Diamagnetický.
Tvrdost
2,0 na Mohsově stupnici.
Izotopy
Existuje pět přírodních a stabilních izotopů selenu, které jsou uvedeny níže s jejich příslušným množstvím:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropy

Selen připravený chemickými reakcemi je cihlově červený amorfní prášek, který při rychlém roztavení vede ke sklovité černé formě, podobně jako růženec (horní obrázek). Černý selen je křehká a lesklá pevná látka.
Černý selen je také mírně rozpustný v sirníku uhlíku. Když se tento roztok zahřeje na 180 ° C, vysráží selen selen, jeho nejstabilnější a nejhustší allotrope..
Šedý selen je odolný vůči oxidaci a je inertní vůči působení neoxidujících kyselin. Hlavní vlastností tohoto selenu je jeho fotovodivost. Při osvětlení se jeho elektrická vodivost zvyšuje 10krát až 15krát.
Reaktivita
Selen ve svých sloučeninách existuje v oxidačních stavech -2, +4 a +6. Vykazuje jasnou tendenci k tvorbě kyselin ve vyšších oxidačních stavech. Sloučeniny, které mají selen v oxidačním stavu -2, se nazývají selenidy (Sedva-).
Reakce s vodíkem
Selen reaguje s vodíkem za vzniku selenidu vodíku (H.dvaSe), bezbarvý, hořlavý a zapáchající plyn.
Reakce s kyslíkem
Popáleniny selenu vyzařující modrý plamen a tvořící oxid seleničitý:
vím8 (s) + 8 °dva => 8 SeOdva (s)
Oxid seleničitý je pevná, bílá, polymerní látka. Jeho hydratace produkuje kyselinu seleničitou (HdvaSeo3). Také selen tvoří oxid seleničitý (SeO3), analogický síře (SO3).
Reakce s halogeny
Selen reaguje s fluorem za vzniku hexafluoridu selenu:
vím8 (s) + 24 F.dva (g) => 8 SeF6 (l)
Selen reaguje s chlorem a bromem za vzniku disileniumdichloridu a dibromidu:
vím8 (s) + 4 Cldva => 4 SedvaCldva
vím8 (s) + 4 Brdva => 4 SedvaBrdva
Selen může také tvořit SeF4 a SeCl4.
Na druhou stranu selen tvoří sloučeniny, ve kterých se atom selenu spojuje s jedním z halogenu a druhým s kyslíkem. Důležitým příkladem je oxychlorid seleničitý (SeOdvaCldva), se selenem v oxidačním stavu +6, extrémně silným rozpouštědlem.
Reakce s kovy
Selen reaguje s kovy za vzniku selenidů hliníku, kadmia a sodíku. Chemická rovnice níže odpovídá rovnici pro tvorbu selenidu hlinitého:
3 Se8 + 16 Al => 8 Aldvavím3
Selenity
Selen tvoří soli známé jako selenity; například: seleničitan stříbrný (AgdvaSeo3) a seleničitan sodný (NadvaSeo3). Toto jméno bylo v literárním kontextu používáno k označení obyvatel Měsíce: Selenitů.
Kyseliny
Nejdůležitější kyselinou v selenu je kyselina selenová (HdvaSeo4). Je stejně silný jako kyselina sírová a snáze se redukuje.
Struktura a elektronická konfigurace
- Selen a jeho odkazy
Selen má šest valenčních elektronů, a proto se nachází ve skupině 16, stejně jako kyslík a síra. Těchto šest elektronů je podle jejich elektronické konfigurace na orbitálech 4s a 4p:
[Ar] 3d10 4 sdva 4p4
Proto potřebuje, stejně jako síra, vytvořit dvě kovalentní vazby k dokončení svého valenčního oktetu; i když má dostupnost svých 4d orbitalů pro vazbu s více než dvěma atomy. Tři atomy selenu se tedy spojují a tvoří dvě kovalentní vazby: Se-Se-Se.
Selen s nejvyšší atomovou hmotou má přirozenou tendenci vytvářet struktury řízené kovalentními vazbami; místo toho, aby byly uspořádány jako diatomické molekuly Sedva, Se = Se, analogicky k Odva, O = O.
- Prsteny nebo řetězy
Z molekulárních struktur, které atomy selenu přijímají, lze obecně zmínit dva: kruhy nebo řetězce. Všimněte si, že v hypotetickém případě Se3, atomy Se na koncích stále vyžadují elektrony; proto musí být postupně navázány na jiné atomy, dokud nebude možné řetězec uzavřít do kruhu.
Nejběžnější kruhy jsou osmičlenné kruhy nebo atomy selenu:8 (selenitová koruna). Proč osm? Protože čím menší je prsten, tím více stresu bude trpět; to znamená, že úhly jejich vazeb se odchylují od přirozených hodnot stanovených jejich sp hybridizacemi3 (podobné jako u cykloalkanů).
Protože existuje osm atomů, je oddělení mezi atomy Se-Se dostatečné, takže jejich vazby jsou „uvolněné“ a ne „ohnuté“; i když úhel jeho článků je 105,7 ° a ne 109,5 °. Na druhou stranu mohou existovat menší kroužky:6 a7.
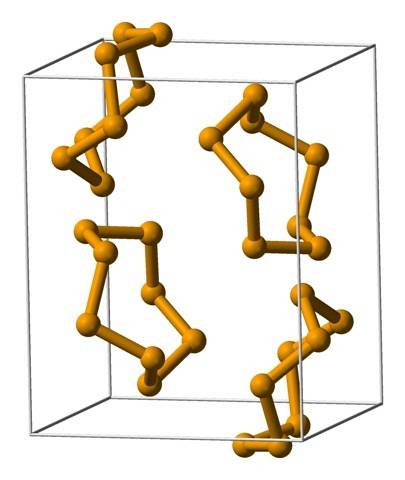
Horní obrázek ukazuje jednotky Se ring.8. Všimněte si podobnosti, kterou mají s sirnými korunami; jen jsou větší a těžší.
Kromě kruhů mohou být atomy selenu také uspořádány do spirálovitých řetězců (pomyslete na točitá schodiště):
Na jeho koncích mohou být koncové dvojné vazby (-Se = Se) nebo Se kroužky8.
- Allotropes
Vezmeme-li v úvahu, že mohou existovat spirálovité kruhy nebo řetězce selenu a že jejich rozměry se mohou také lišit v závislosti na počtu atomů, které obsahují, je zřejmé, že pro tento prvek existuje více než jeden alotrop; tj. čisté pevné látky selenu, ale s různými molekulárními strukturami.
Červený selen
Mezi nejvýznamnější allotropy selenu patří červená, která se může jevit jako amorfní prášek nebo jako monoklinické a polymorfní krystaly (viz obrázek Se8).
V amorfním červeném selenu jsou struktury neuspořádané, bez zjevných obrazců; zatímco v čočce vytvářejí prstence monoklinickou strukturu. Červený krystalický selen je polymorfní a má tři fáze: α, β a γ, které se liší svou hustotou..
Černý selen
Struktura černého selenu se také skládá z prstenců; ale ne z osmi členů, ale z mnoha dalších, dosahujících až prstenců s tisíci atomy (Se1000). Poté se říká, že jeho struktura je složitá a skládá se z polymerních kruhů; některé větší nebo menší než jiné.
Jelikož existují polymerní prstence různých velikostí, je těžké očekávat, že vytvoří strukturální řád; takže černý selen je také amorfní, ale na rozdíl od výše zmíněného načervenalého prášku má skelné textury, i když je křehký.
Šedý selen
A konečně, z nejjednodušších alotropů selenu je šedá, která vyniká nad ostatními, protože je za normálních podmínek nejstabilnější a má také kovový vzhled..
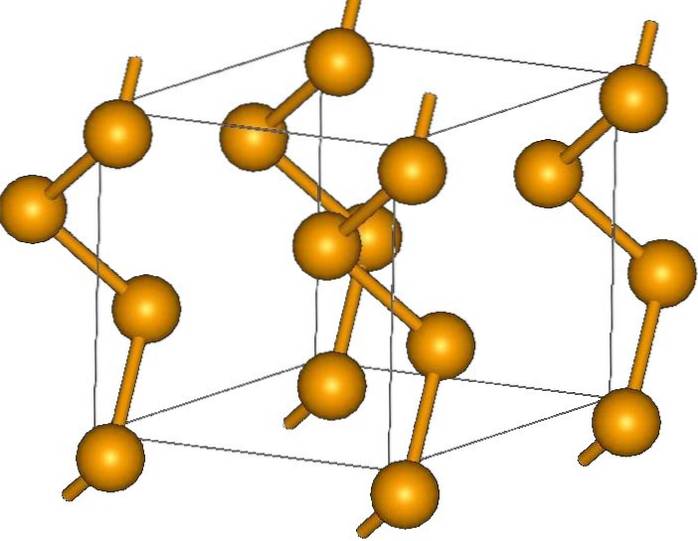
Jeho krystaly mohou být šestihranné nebo trigonální, což je dáno Londonovými disperzními silami mezi jeho polymerními spirálovými řetězci (horní obrázek). Úhel jejich vazeb je 130,1 °, což naznačuje pozitivní odchylku od čtyřbokého okolí (s úhly 109,5 °)..
Proto selenové spirálové řetězy budí dojem, že jsou „otevřené“. Pro objasnění, v této struktuře jsou atomy proti sobě, takže teoreticky musí existovat větší přesah jejich orbitalů, aby se vytvořily vodivé pásy.
Teplo se zvýšením molekulárních vibrací tyto pásy poškozuje, když dojde k narušení řetězů; zatímco energie fotonu přímo ovlivňuje elektrony, vzrušuje je a podporuje jejich transakce. Z tohoto hlediska je „snadné“ si představit fotovodivost šedého selenu..
Kde se nachází a kde se nachází výroba
I když je selen široce distribuován, je vzácným prvkem. Nachází se v původním stavu spojeném se sírou a minerály, jako je eucairit (CuAgSe), klaustalit (PbSe), naumanit (AgdvaSe) a crookesite [(CuTiAg)dvaVím].
Selen se nalézá jako nečistota, která nahrazuje síru v malé části sirných minerálů kovů; jako měď, olovo, stříbro atd..
Existují půdy, ve kterých selen existuje v rozpustné formě selenátů. Ty jsou dešťovou vodou přenášeny do řek a odtud do oceánu.
Některé rostliny jsou schopné selen absorbovat a koncentrovat. Například šálek para ořechů obsahuje 544 µg selenu, což je množství, které odpovídá 777% denního doporučeného množství selenu..
U živých bytostí selen nachází v některých aminokyselinách, jako jsou: selenomethionin, selenocystein a methylselenocystein. Selenocystein a seleničitan se redukují na selenid vodíku.
Elektrolýza mědi
Neexistuje těžba selenu. Většina z nich se získává jako vedlejší produkt procesu rafinace elektrolýzou mědi, který se nachází v bahně, která se hromadí na anodě..
Prvním krokem je výroba oxidu seleničitého. Za tímto účelem se anodické bahno zpracuje uhličitanem sodným za účelem jeho oxidace. Potom se k oxidu seleničitému přidá voda a okyselí se za vzniku kyseliny selenové..
Nakonec se kyselina seleničitá zpracuje s oxidem siřičitým, aby se snížil jeho obsah a získal elementární selen..
Při jiném způsobu ve směsi bahna a kalu vznikajícího při výrobě kyseliny sírové se získá nečistý červený selen, který se rozpouští v kyselině sírové..
Poté se vytvoří kyselina seleničitá a kyselina selenová. Tato kyselina selenová je ošetřena stejným způsobem jako předchozí metoda.
Chlor, který působí na selenidy kovů, lze také použít k výrobě těkavých sloučenin chlorovaného selenu; jako například: SedvaCldva, SeCl4, SeCldva a SeOCldva.
Tyto sloučeniny se při způsobu prováděném ve vodě přeměňují na kyselinu seleničitou, která se zpracovává oxidem siřičitým za uvolnění selenu..
Biologická role
Nedostatek
Selen je základním stopovým prvkem pro rostliny a zvířata, jejichž nedostatek u lidí způsobil vážné poruchy, jako je Keshanova choroba; onemocnění charakterizované poškozením myokardu.
Nedostatek selenu je navíc spojen s mužskou neplodností a může hrát roli při Kashin-Beckově chorobě, typu osteoartritidy. Nedostatek selenu byl také pozorován u revmatoidní artritidy.
Enzymový kofaktor
Selen je složka enzymů s antioxidačním účinkem, jako je glutathionperoxidáza a thioredoxin reduktáza, které působí na eliminaci látek reaktivním kyslíkem..
Kromě toho je selen kofaktorem hormonů jodidázy štítné žlázy. Tyto enzymy jsou důležité při regulaci fungování hormonů štítné žlázy..
Bylo popsáno použití selenu při léčbě Hasimotovy choroby, autoimunitního onemocnění s tvorbou protilátek proti buňkám štítné žlázy..
Selen se také používá ke snížení toxických účinků rtuti, protože některé jeho účinky jsou vyvíjeny na antioxidační enzymy závislé na selenu.
Proteiny a aminokyseliny
Člověk má asi 25 selenoproteinů, které mají antioxidační účinek na ochranu před oxidačním stresem, iniciovaný přebytkem reaktivních forem kyslíku (ROS) a reaktivních forem dusíku (NOS)..
U lidí byla zjištěna přítomnost aminokyselin selenomethiocinu a selenocysteinu. Selenomethionin se používá jako doplněk stravy při léčbě stavů s nedostatkem selenu.
Rizika
Vysoká tělesná koncentrace selenu může mít řadu škodlivých účinků na zdraví, počínaje lámavými vlasy a lámavými nehty, kožními vyrážkami, teplem, otoky kůže a silnými bolestmi..
Při léčbě selenu v kontaktu s očima mohou lidé pociťovat pálení, podráždění a slzení. Mezitím může dlouhodobé vystavení kouři s vysokým obsahem selenu způsobit plicní edém, česnekový dech a bronchitidu..
Kromě toho může osoba zaznamenat pneumonitidu, nevolnost, zimnici, horečku, bolest v krku, průjem a hepatomegálii..
Selen může interagovat s jinými léky a doplňky stravy, jako jsou antacida, antineoplastická léčiva, kortikosteroidy, niacin a antikoncepční pilulky..
Selen je spojován se zvýšeným rizikem rakoviny kůže. Studie Národního onkologického institutu zjistila, že u mužů s vysokou úrovní selenu v těle byla dvakrát vyšší pravděpodobnost, že budou trpět agresivním karcinomem prostaty.
Studie naznačuje, že denní příjem 200 µg selenu zvyšuje možnost vzniku cukrovky typu II o 50%.
Aplikace
Kosmetika
Sulfid seleničitý se používá při léčbě seborey, stejně jako mastných vlasů nebo lupů.
Lékaři
Používá se jako alternativní lék při léčbě Hasimotovy choroby, autoimunitního onemocnění štítné žlázy.
Selen snižuje toxicitu rtuti, jedna z jeho toxických aktivit je vyvíjena na deoxidační enzymy, které používají selen jako kofaktor.
Elektrolýza manganu
Použití oxidu seleničitého při elektrolýze manganu značně snižuje náklady na techniku, protože snižuje spotřebu elektřiny.
Pigment
Selen se používá jako pigment v barvách, plastech, keramice a skle. V závislosti na použitém selenu se barva skla mění od tmavě červené po světle oranžovou..
Fotovodivý
Kvůli vlastnosti šedého selenu měnit svou elektrickou vodivost v závislosti na intenzitě světla, které ho vyzařuje, selen byl použit ve fotokopírkách, fotobunkách, fotometrech a solárních článcích.
Jednou z hlavních aplikací selenu bylo použití selenu v kopírkách; ale vzhled organických fotovodičů snižuje jejich použití.
Krystaly
Selen se používá k zabarvení skel v důsledku přítomnosti železa, které vytváří zelené nebo žluté zbarvení. Kromě toho umožňuje červené zbarvení skla, v závislosti na použití, které mu chcete poskytnout..
Vulkanizace
Diethyldithiokarbonát selen se používá jako vulkanizační činidlo v pryžových výrobcích.
Slitiny
Selen se používá v kombinaci s vizmutem v mosazi jako náhrada olova; Velmi toxický prvek, který díky doporučením zdravotnických organizací snižuje jeho používání.
Selen se přidává v nízké koncentraci do oceli a slitin mědi, aby se zlepšila použitelnost těchto kovů..
Usměrňovače
Usměrňovače selenu se začaly používat v roce 1933 až do 70. let, kdy byly kvůli nízké ceně a vynikající kvalitě nahrazeny křemíkem..
Reference
- Královský australský chemický institut. (2011). Selen. [PDF]. Obnoveno z: raci.org.au
- Wikipedia. (2019). Selen. Obnoveno z: en.wikipedia.org
- Sato Kentaro. (s.f.). Nové alotropy prvků hlavní skupiny. [PDF]. Obnoveno z: tcichemicals.com
- Dr. Dough Stewart. (2019). Fakta o prvku selenu. Chemicool. Obnoveno z: chemicool.com
- Robert C. Brasted. (28. srpna 2019). Selen. Encyklopedie Britannica. Obnoveno z: britannica.com
- Marques Miguel. (s.f.). Selen. Obnoveno z: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (3. července 2019). Fakta o selenu. Obnoveno z: thoughtco.com
- Lenntech B.V. (2019). Periodická tabulka: selen. Obnoveno z: lenntech.com
- Tinggi U. (2008). Selen: jeho role jako antioxidantu v lidském zdraví. Zdraví životního prostředí a preventivní medicína, 13(2), 102-108. doi: 10,1007 / s12199-007-0019-4
- Úřad doplňků stravy. (9. července 2019). Selen: Informační list pro zdravotnické pracovníky. Národní institut zdraví. Obnoveno z: ods.od.nih.gov



Zatím žádné komentáře