
Vlastnosti syncytiotrofoblastů, funkce, placentární apoptóza
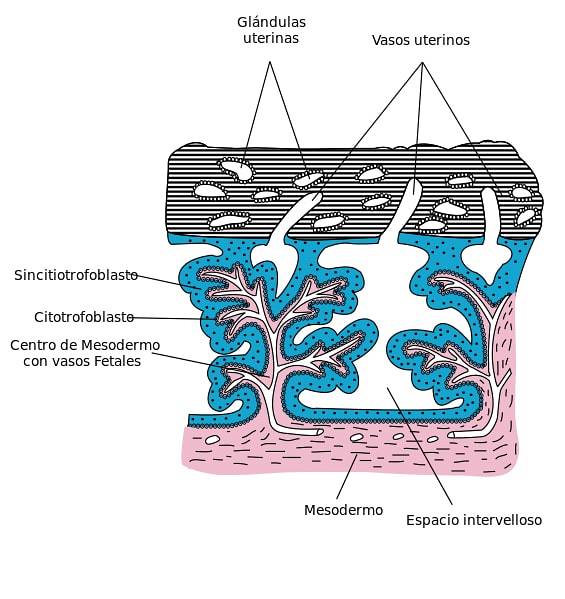
The syncytiotrofoblast Jedná se o vícejadernou cytoplazmatickou hmotu, která tvoří vnější vrstvu trofoblastu a kontaktuje mateřskou tkáň. Tato buněčná vrstva se nachází v průběhu embryonálního vývoje savců napadajících epitel a stroma endometria. Buňky, které tvoří syncytiotrofoblast, se navzájem fúzují a ztrácejí buněčné membrány.
Tato vrstva buněk pochází z buněčné diferenciace cytotrofoblastů a je zodpovědná za výměnu plynů a živin mezi matkou a plodem. Kromě toho je schopen produkovat hormony a peptidy ve fázi implantace blastocysty do endometria a tvorby placenty..
Rejstřík článků
- 1 Funkce
- 2 Role v embryonálním vývoji
- 2.1 Nidace nebo implantace
- 2.2 Uteroplacentární oběh
- 3 Placentární apoptóza
- 3.1 Apoptóza a preeklampsie
- 3.2 Důkazy o vztahu mezi apoptózou a preeklampsií
- 4 Odkazy
Vlastnosti
Jak název napovídá, syncytiotrofoblastové buňky ztratily membrány a fúzovaly, což této buněčné vrstvě poskytlo vícejaderný syncyciální vzhled..
Tyto buňky nepřetržitě pokrývají choriový vilózní povrch, decidua basalis a choriový talíř a tvoří část placentární bariéry, která je zodpovědná za separaci krve matky a plodu.
Syncytiotrofoblast pochází z proliferace a fúze buněk cytotrofoblastů. Buňky této vrstvy nemají proliferační kapacitu, to znamená, že neprocházejí mitózou, takže expanze a údržba této buněčné vrstvy závisí pouze na kontinuálním zabudování buněk z cytotrofoblastu a zajištění jejich funkčnosti..
Tyto buňky mají Golgiho komplexy a bohaté hladké a drsné endoplazmatické retikulum, stejně jako velké množství mitochondrií a lipidových inkluzí..
Tato vrstva buněk má také sekreční funkci, uvolňuje progesteron, estrogen, lidský choriový gonadotropin (hCG) a laktogeny. Jak buněčný materiál stárne, je zabalen do ochranné membrány a likvidován mateřskou cirkulací..
Role v embryonálním vývoji
Nidace nebo implantace
Blastocysta se připojuje k endometriu a iniciuje fázi rychlé buněčné proliferace s diferenciací trofoblastu na cytotrofoblast a syncytiotrofoblast. Ten prochází endometriálním epitelem, dokud nedosáhne svého strómy, kde se buňky plní lipidy a glykogenem a stávají se deciduálními buňkami..
Tyto deciduální buňky procházejí degenerativními procesy, které jim umožňují dodávat živiny vyvíjejícímu se embryu..
Jakmile je blastocysta implantována do endometria implantací nebo vnořením, fúze nejvzdálenějších buněk trofoblastu vede k primitivnímu syncytiotrofoblastu.
Později se vytvářejí laguny obsazené žlázovými sekrecemi endometria, které budou později nahrazeny mateřskou krví, oslabením kapilárních cév a žil endometria..
Tyto intracelulární mezery naplněné mateřskou krví definují lakunární nebo trabekulární fázi a rozšiřují se, dokud nedosáhnou opačné strany implantačního bodu..
Mezery v syncytiotrofoblastu se nazývají trabeculae. V této fázi dochází také k embryogenezi, která spočívá ve změnách embryoblastu uvnitř blastocysty..
Utero-placentární oběh
Jednou ze základních funkcí syncytiotrofoblastu je metabolická výměna mezi matkou a plodem, která prokazuje vysokou endokrinní aktivitu a podílí se na homeostáze embryonálního vývoje..
Vzhled intracelulárních nebo trofoblastických mezer v syncytiotrofoblastu zahajuje vývoj utero-placentárního oběhu. Sinusoidy odvozené z kapilár mateřské části placenty proudí do těchto lagun..
Směrový tok je tvořen diferenčním tlakem mezi oběhovými cévami a trofoblastickými lagunami. Tento tok jde z tepen do žil, tvoří primitivní utero-placentární oběh..
Dochází k přenosu živin z mateřských cév do embrya, což je evidentní při pozorování hojných pinocytických vezikul syncytiotrofoblastu..
Syncyciální buněčná vrstva lemuje plovoucí klky placenty. Tyto klky přicházejí do styku s mateřskou krví, když se vytvoří utero-placentární oběh, čímž regulují transport kyslíku a živin..
Placentární apoptóza
Ukázalo se, že apoptóza nebo programovaná buněčná smrt je důležitou součástí embryonálního vývoje, takže dochází k eliminaci vybraných buněk, aby se zabránilo nerozlišující ztrátě buněk. Syncyciální fúze cytotrofoblastových buněk je počáteční fází apoptotické kaskády.
V počátečním stádiu apoptózy buňky cytotrofoblastů proliferují a fúzují za vzniku syncytiální vrstvy nebo syncytiotrofoblastu..
Ve fázi provádění apoptózy prošel cytoplazmatický a nukleový materiál cytotrofoblastu do syncyciální vrstvy, takže buňky této poslední vrstvy jsou vybaveny materiálem nezbytným pro spuštění apoptotické kaskády..
Apoptotický proces představuje dočasnou pauzu v důsledku působení antiapoptotických enzymů, avšak enzym kaspázy 3 tento proces znovu aktivuje, protože zase aktivuje složky, které degradují proteiny a nukleové kyseliny v buňkách. Aktivují se další enzymy odpovědné za degradaci buněčných mikrofilament.
Po degradaci buněčných složek je odpad zabalen do apikálních membrán syncytiotrofoblastu, přičemž vznikají syncytiální nebo apoptotické uzliny, které budou nakonec uvolněny do matčiny krve..
Apoptóza a preeklampsie
Preeklampsie je patologie prezentovaná během těhotenství. Některé výzkumy ukázaly, že tato patologie je způsobena změnou diferenciace trofoblastu v důsledku přebytku apoptotických procesů na této úrovni.
Uvolňování apoptotických odpadů do mateřského krevního oběhu nevyvolává u matky zánětlivé reakce, protože tyto odpady jsou chráněny membránou, která jim brání v kontaktu s mateřskými strukturami. Proces povlékání trosek trvá několik týdnů.
U preeklampsie dochází k přebytku proliferace a fúze buněk cytotrofoblastů, což způsobuje zvýšení buněčné degradace v syncytiotrofoblastu. Toto zvýšení způsobuje hromadění buněčných úlomků a zpoždění při tvorbě jejich ochranné membrány..
To způsobí, že se částečně degradované trosky a mikrofragmenty, včetně syncytiotrofoblastových enzymů, dostanou do matčiny krve a způsobí poškození tkáně. Kromě preeklampsie byly hypoxické stavy v placentě spojeny se zvýšením buněčné apoptózy.
Důkazy o vztahu mezi apoptózou a preeklampsií
U pacientů s preeklampsií byly zjištěny významné cytoplazmatické koncentrace mikrofragmentů syncytiotrofoblastu. Tyto mikrofragmenty mohou změnit chování makrofágů, což způsobí jak zvýšenou aktivaci neutrofilů, tak sníženou relaxaci endotelu..
Tyto změny v krevních buňkách matky vysvětlují systémové poškození a projevy preeklampsie, které způsobují poškození epitelu a zánětlivou reakci. Kromě způsobení poškození placenty v důsledku zvýšení fibrinoidních depozit na klcích.
Reference
- Flores, A. M., Montoya, J. B., Aguilar, A. O. a Ortega, F. V. (2006). Vývoj a validace modelu kultury in vitro pro studium diferenciace lidských trofoblastů. Gynekologie a porodnictví v Mexiku, 74 (12), 657-665.
- Hernández-Valencial, M., Valencia-Ortega, J., Ríos-Castillo, B., Cruz-Cruz, P. D. R., & Vélez-Sánchez, D. (2014). Prvky implantace a placentace: klinické a melekulární aspekty. Mexický žurnál reprodukční medicíny, 6 (2), 102-116.
- Reece, E. A., & Hobbins, J. C. (2010). Klinické porodnictví / Klinické porodnictví. Panamerican Medical Ed..
- Rodríguez, M., Couve, C., Egaña, G., & Chamy, V. (2011). Placentární apoptóza: molekulární mechanismy v genezi preeklampsie. Chilský časopis porodnictví a gynekologie, 76 (6), 431-438.
- Ross, M. H. a Pawlina, W. (2007). Histologie. Panamerican Medical Ed..
- Roura, L. C. (2007). Porodnictví a mateřsko-fetální medicína. Panamerican Medical Ed..



Zatím žádné komentáře