
Přesycené vlastnosti řešení, příprava, příklady
The přesycený roztok Je to ten, ve kterém rozpouštědlo rozpouští více rozpuštěných látek, než kolik dokáže rozpouštět při rovnováze nasycení. Všechny mají společnou saturační rovnováhu, s tím rozdílem, že v některých řešeních se toho dosahuje při nižších nebo vyšších koncentracích rozpuštěné látky..
Rozpuštěnou látkou může být pevná látka, jako je cukr, škrob, soli atd .; nebo z plynu, jako je COdva v sycených nápojích. Použitím molekulárního uvažování molekuly rozpouštědla obklopují molekuly rozpuštěné látky a snaží se mezi sebou otevřít prostor, aby bylo možné pojmout více rozpuštěné látky..

Nastává tedy doba, kdy afinita rozpouštědla a rozpuštěné látky nemůže překonat nedostatek prostoru a nastolit rovnováhu nasycení mezi krystalem a jeho okolím (roztokem). V tomto okamžiku nezáleží na tom, kolik jsou krystaly rozemleté nebo protřepané - rozpouštědlo již nemůže rozpouštět další rozpuštěné látky.
Jak „donutit“ rozpouštědlo rozpustit více rozpuštěných látek? Prostřednictvím zvýšení teploty (nebo tlaku, v případě plynů). Tímto způsobem se zvyšují molekulární vibrace a krystal začíná uvolňovat více svých molekul k rozpouštění, dokud se úplně nerozpustí; to je, když se říká, že řešení je přesycené.
Horní obrázek ukazuje přesycený roztok octanu sodného, jehož krystaly jsou produktem obnovení rovnováhy nasycení.
Rejstřík článků
- 1 Teoretické aspekty
- 1.1 Sytost
- 1.2 přesycení
- 2 Funkce
- 3 Jak se připravujete?
- 4 Příklady a aplikace
- 5 Reference
Teoretické aspekty
Nasycení
Roztoky mohou být vyrobeny ze směsi, která zahrnuje skupenství hmoty (pevné, kapalné nebo plynné); vždy však mají jednu fázi.
Když rozpouštědlo nemůže úplně rozpustit rozpuštěnou látku, je následkem toho pozorována další fáze. Tato skutečnost odráží rovnováhu sytosti; ale o čem je tato rovnováha?
Ionty nebo molekuly interagují a vytvářejí krystaly, které se vyskytují s větší pravděpodobností, protože rozpouštědlo je nemůže déle udržovat od sebe..
Na povrchu skla se jeho součásti srazí a přilnou k němu, nebo se mohou také obklopit molekulami rozpouštědla; někteří vyjdou, někteří se drží. Výše uvedené lze vyjádřit následující rovnicí:
Pevný <=> rozpuštěná pevná látka
Ve zředěných roztocích je „rovnováha“ zcela vpravo, protože mezi molekulami rozpouštědla je k dispozici spousta prostoru. Na druhou stranu, v koncentrovaných roztocích může rozpouštědlo stále rozpouštět rozpuštěné látky a pevná látka, která se přidá po míchání, se rozpustí.
Jakmile je dosaženo rovnováhy, částice přidané pevné látky, jakmile se rozpustí v rozpouštědle, a ostatní v roztoku, musí „vyjít“ do otevřeného prostoru a umožnit jejich začlenění do kapalné fáze. Rozpuštěná látka tedy přichází a odchází stejnou rychlostí z pevné fáze do kapalné fáze; když k tomu dojde, říká se, že je roztok nasycený.
Přesycení
K vynucení rovnováhy k rozpuštění pevnější látky musí kapalná fáze otevřít molekulární prostor, a proto je nutné ji energicky stimulovat. To způsobí, že rozpouštědlo za okolních teplotních a tlakových podmínek přijme více rozpuštěných látek, než je obvyklé..
Jakmile přestane příspěvek energie do kapalné fáze, přesycený roztok zůstane metastabilní. Proto v případě jakéhokoli narušení může narušit rovnováhu a způsobit krystalizaci přebytečné rozpuštěné látky, dokud opět nedosáhne rovnováhy nasycení..
Například, vzhledem k rozpuštěné látce, která je velmi rozpustná ve vodě, se přidává určité množství, dokud se pevná látka nemůže rozpustit. Poté se na vodu aplikuje teplo, dokud není zaručeno rozpuštění zbývající pevné látky. Přesycený roztok se odstraní a nechá se ochladit.
Pokud je chlazení velmi prudké, dojde ke krystalizaci okamžitě; například přidání trochu ledu do přesyceného roztoku.
Stejný účinek lze pozorovat také v případě, že se do vody vrhne krystal rozpustné sloučeniny. To slouží jako podpora nukleace pro rozpuštěné částice. Krystal roste hromaděním částic média, dokud se kapalná fáze nestabilizuje; to znamená, dokud není roztok nasycen.
Vlastnosti
V přesycených roztocích byla překročena mez, ve které již není rozpuštěno množství rozpuštěné látky rozpouštědlem; proto má tento typ řešení přebytek rozpuštěné látky a má následující vlastnosti:
-Mohou existovat se svými složkami v jedné fázi, jako ve vodných nebo plynných roztocích, nebo mohou být přítomny jako směs plynů v kapalném médiu..
-Po dosažení stupně nasycení rozpuštěná látka snadno v roztoku krystalizuje nebo se vysráží (vytvoří neorganizovanou pevnou látku, nečistou a bez strukturních vzorů)..
-Je to nestabilní řešení. Když se vysráží přebytek nerozpuštěné látky, dojde k uvolnění tepla, které je úměrné množství sraženiny. Toto teplo je generováno místním šokem nebo in situ molekul, které krystalizují. Protože se stabilizuje, musí nutně uvolňovat energii ve formě tepla (v těchto případech).
-Některé fyzikální vlastnosti, jako je rozpustnost, hustota, viskozita a index lomu, závisí na teplotě, objemu a tlaku, kterému je roztok vystaven. Z tohoto důvodu má jiné vlastnosti než příslušné nasycené roztoky..
Jak se připravuješ?
Při přípravě roztoků existují proměnné, jako je typ a koncentrace rozpuštěné látky, objem rozpouštědla, teplota nebo tlak. Modifikací kteréhokoli z nich lze přesycený roztok připravit z nasyceného..
Když řešení dosáhne stavu nasycení a jedna z těchto proměnných se změní, lze získat přesycené řešení. Obecně je výhodnou proměnnou teplota, i když to může být také tlak.
Pokud je přesycený roztok podroben pomalému odpařování, částice pevné látky se setkají a mohou tvořit viskózní roztok nebo celý krystal.
Příklady a aplikace

-Existuje velké množství solí, kterými lze získat přesycené roztoky. Byly používány po dlouhou dobu průmyslově a komerčně a byly předmětem rozsáhlého výzkumu. Aplikace zahrnují roztoky síranu sodného a vodné roztoky dichromanu draselného.
-Dalšími příklady jsou přesycené řešení tvořené sladkými řešeními, jako je med. Z těchto cukrovinek nebo sirupů se připravují zásadní význam v potravinářském průmyslu. Je třeba poznamenat, že se také používají ve farmaceutickém průmyslu při přípravě některých léků..
Reference
- The Chemistry Companion for Middle School Teachers Science. Řešení a koncentrace. [PDF]. Citováno dne 7. června 2018 z: ice.chem.wisc.edu
- K. Taimni. (1927). Viskozita přesycených roztoků. Já. The Journal of Physical Chemistry32(4), 604-615 DOI: 10.1021 / j150286a011
- Szewczyk, W. Sokolowski a K. Sangwal. (1985). Některé fyzikální vlastnosti nasycených, přesycených a nenasycených vodných roztoků bichromanu draselného. Journal of Chemical & Engineering Data30(3), 243-246. DOI: 10.1021 / je00041a001
- Wikipedia. (2018). Přesycení. Citováno dne 8. června 2018 z: en.wikipedia.org/wiki/Supersaturation
- Roberts, Anna. (24. dubna 2017). Jak vyrobit přesycené řešení. Vědění. Citováno dne 8. června 2018 z: sciencing.com
- TutorVista. (2018). Přesycené řešení. Citováno dne 8. června 2018 z: chemistry.tutorvista.com
- Neda Glisovic. (2015, 25. května). Kristalizacija. [Postava]. Citováno dne 8. června 2018 z: commons.wikimedia.org


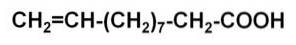
Zatím žádné komentáře