
Vlastnosti pufrovacích roztoků, příprava, příklady

The pufrovací roztoky nebo pufry jsou ty, které mohou snížit změny pH v důsledku iontů H3NEBO+ a OH-. Při absenci těchto jsou některé systémy (například fyziologické) poškozeny, protože jejich složky jsou velmi citlivé na náhlé změny pH.
Stejně jako tlumiče nárazů v automobilech snižují náraz způsobený jejich pohybem, nárazníky dělají totéž, ale s kyselostí nebo zásaditostí řešení. Kromě toho pufry stanoví specifické rozmezí pH, ve kterém jsou účinné..

Jinak H ionty3NEBO+ okyselí roztok (pH klesne na hodnoty pod 6), což má za následek možnou změnu ve výtěžku reakce. Stejný příklad lze použít pro základní hodnoty pH, tj. Vyšší než 7.
Rejstřík článků
- 1 Funkce
- 1.1 Složení
- 1.2 Neutralizují jak kyseliny, tak zásady
- 1.3 Účinnost
- 2 Příprava
- 3 příklady
- 4 Odkazy
Vlastnosti
Složení
V zásadě se skládají z kyseliny (HA) nebo slabé báze (B) a solí jejich konjugované báze nebo kyseliny. V důsledku toho existují dva typy: kyselé pufry a alkalické pufry..
Kyselinové pufry odpovídají dvojici HA / A-, kam- je konjugovaná báze slabé kyseliny HA a interaguje s ionty - jako je Na+- za vzniku sodných solí. Tímto způsobem zůstává pár jako HA / NaA, i když to mohou být také draselné nebo vápenaté soli.
Odvozeno od slabě kyselé HA, tlumí rozsahy kyselého pH (méně než 7) podle následující rovnice:
HA + OH- => A- + HdvaNEBO
Jelikož je však slabou kyselinou, její konjugovaná báze je částečně hydrolyzována, aby regenerovala část spotřebovaného HA:
NA- + HdvaNEBO <=> HA + OH-
Na druhé straně se alkalické pufry skládají z páru B / HB+, kde HB+ je to konjugovaná kyselina slabé báze. Obecně platí, že HB+ tvoří soli s chloridovými ionty a ponechává pár jako B / HBCl. Tyto pufry pufrují základní rozsahy pH (větší než 7):
B + H3NEBO+ => HB+ + HdvaNEBO
A znovu, HB+ lze částečně hydrolyzovat k regeneraci části spotřebované B:
HB+ + HdvaNEBO <=> B + H3NEBO+
Neutralizují jak kyseliny, tak zásady
Zatímco kyselé pufry pufrují kyselé pH a alkalické pufry zásadité pH, oba mohou reagovat s H ionty.3NEBO+ a OH- prostřednictvím těchto sérií chemických rovnic:
NA- + H3NEBO+ => HA + HdvaNEBO
HB+ + Ach- => B + HdvaNEBO
Tedy v případě HA / A páru-, HA reaguje s OH ionty-, zatímco A- -jeho konjugovaná báze - reaguje s H3NEBO+. Pokud jde o pár B / HB+, B reaguje s H ionty3NEBO+, zatímco HB+ -jeho konjugovaná kyselina - s OH-.
To umožňuje oběma pufrům neutralizovat kyselé i bazické druhy. Výsledek výše uvedeného versus například neustálé přidávání molů OH-, je pokles variace pH (ΔpH):
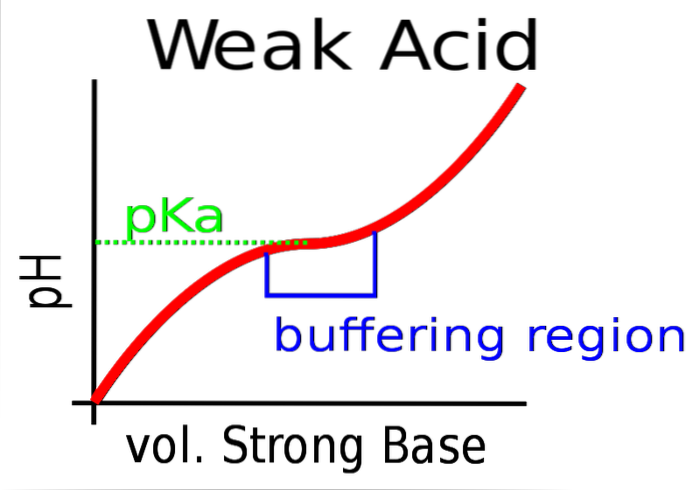
Horní obrázek ukazuje pufrování pH proti silné bázi (dárce OH-).
Zpočátku je pH kyselé kvůli přítomnosti HA. Když se přidá silná báze, vytvoří se první moly A- a vyrovnávací paměť se začne projevovat.
Existuje však oblast křivky, kde je svah méně strmý; tj. kde je tlumení účinnější (namodralý rámeček).
Účinnost
Existuje několik způsobů, jak pochopit koncept účinnosti tlumení. Jedním z nich je stanovení druhé derivace křivky pH versus objem báze, řešení pro V pro minimální hodnotu, což je Veq / 2.
Veq je objem v bodě ekvivalence; toto je objem báze potřebný k neutralizaci veškeré kyseliny.
Další způsob, jak to pochopit, je prostřednictvím slavné Henderson-Hasselbalchovy rovnice:
pH = pKna + protokol ([B] / [A])
Zde B označuje bázi, A kyselinu a pKna je nejmenší logaritmus konstanty kyselosti. Tato rovnice platí jak pro kyselé druhy HA, tak pro konjugovanou kyselinu HB+.
Pokud je [A] velmi velké vzhledem k [B], log () má velmi zápornou hodnotu, která se odečte od pKna. Pokud je naopak [A] vzhledem k [B] velmi malá, nabývá hodnota log () velmi kladné hodnoty, která se přičte k pKna. Když je však [A] = [B], log () je 0 a pH = pKna.
Co znamená všechno výše uvedené? Že ΔpH bude větší v extrémech uvažovaných pro rovnici, zatímco bude minimální s pH rovným pKna; a jako pKna je charakteristický pro každou kyselinu, tato hodnota určuje rozsah pKna± 1.
Hodnoty pH v tomto rozmezí jsou ty, ve kterých je pufr nejúčinnější..
Příprava
Chcete-li připravit pufrovací roztok, musíte mít na paměti následující kroky:
- Znát požadované pH, a tedy to, které chcete během reakce nebo procesu udržovat co nejkonstantnější.
- Znalost pH hledá všechny slabé kyseliny, ty, jejichž pKna je blíže k této hodnotě.
- Po výběru druhu HA a výpočtu koncentrace pufru (v závislosti na tom, kolik báze nebo kyseliny je třeba neutralizovat) se zváží potřebné množství jeho sodné soli..
Příklady
Kyselina octová má pKna 4,75, CH3COOH; proto směs určitých množství této kyseliny a octanu sodného, CH3COONa, vytvořte pufr, který účinně pufruje v rozmezí pH (3,75 - 5,75).
Dalšími příklady monoprotických kyselin jsou kyseliny benzoové (C6H5COOH) a mravenčí (HCOOH). Pro každou z nich jejich hodnoty pKna jsou 4,18 a 3,68; proto jejich nejvyšší pufrovací rozsahy pH jsou (3,18-5,18) a (2,68-4,68).
Na druhou stranu polyprotické kyseliny, jako je kyselina fosforečná (H3PO4) a uhličitý (HdvaCO3) mají tolik hodnot pKna protože protony se mohou uvolňovat. H3PO4 má tři pKna (2,12, 7,21 a 12,67) a HdvaCO3 má dva (6 352 a 10 329).
Chcete-li udržovat pH 3 v roztoku, můžete si vybrat mezi HCOONa / HCOOH (pKna= 3,68) a NaHdvaPO4/ H3PO4 (pKna= 2,12).
První pufr, který je kyselinou mravenčí, má blíže pH 3 než pufr s kyselinou fosforečnou; proto HCOONa / HCOOH pufruje lépe při pH 3 než NaHdvaPO4/ H3PO4.
Reference
- Day, R., & Underwood, A. Kvantitativní analytická chemie (páté vydání). PEARSON Prentice Hall, s. 188-194.
- Avsar Aras. (20. dubna 2013). Mini šoky. Citováno dne 9. května 2018 z: commons.wikimedia.org
- Wikipedia. (2018). Pufrovací roztok. Citováno dne 9. května 2018 z: en.wikipedia.org
- Doc. Lubomír Makedonski, PhD. [Doc.]. Pufrovací roztoky. Lékařská univerzita ve Varně.
- Chem Collective. Výukové programy pro vyrovnávací paměť. Citováno dne 9. května 2018 z: chemcollective.org
- askIITians. (2018). Pufrovací roztok. Citováno dne 9. května 2018 z: askiitians.com
- Quimicas.net (2018). Příklady pufru, pufru nebo pufrovacích roztoků. Citováno dne 9. května 2018 z: quimicas.net



Zatím žádné komentáře