
Struktura síranu hlinitého (Al2 (SO4) 3), použití, toxicita

The síran hlinitý je anorganická hliníková sůl vzorce Aldva(SW4)3, který se obvykle jeví jako bílá pevná látka s lesklými krystaly. Barva sloučeniny bude ovlivněna koncentrací železa a dalšími nečistotami. Existují dva hlavní typy síranu hlinitého: A a B..
Dolní obrázek ukazuje bílé krystaly hydratovaného síranu hlinitého. Lze zaznamenat nepřítomnost hnědého zbarvení, což svědčí o iontech železa v krystalové mřížce.

Síran hlinitý je velmi rozpustná sůl ve vodě a v přírodě je vzácné ji najít v bezvodé formě. Obvykle se hydratuje ve formě oktadekhydrátu síranu hlinitého [Aldva(SW4)3.18HdvaO] nebo hexadekahydrát [Aldva(SW4)3.16HdvaNEBO].
Podobně může tvořit podvojné soli s draslíkem as amoniem, sloučeniny známými jako kamence. Částečně to může být způsobeno afinitou vody v hydrátech k zadržování jiných iontů než hliníku..
Síran hlinitý lze štěpit působením vody na hydroxid hlinitý a kyselinu sírovou. Tato vlastnost umožnila jeho použití jako okyselení půdy..
Je to také toxická sloučenina, zvláště při kontaktu s prachem. Má však nesčetné použití a aplikace, od čištění vody pomocí koagulační metody, přes její použití v různých průmyslových odvětvích až po její použití pro terapeutické účely..
Rejstřík článků
- 1 Struktura
- 2 K čemu je (použití)
- 2.1 Srážení nebo vločkování vody
- 2.2 Použití jako inkoustové mořidlo a při výrobě papíru
- 2.3 Průmyslové použití
- 2.4 Léčebné a terapeutické použití
- 2.5 Jiná použití
- 3 Výroba síranu hlinitého
- 4 typy
- 5 Toxicita
- 6 Reference
Struktura
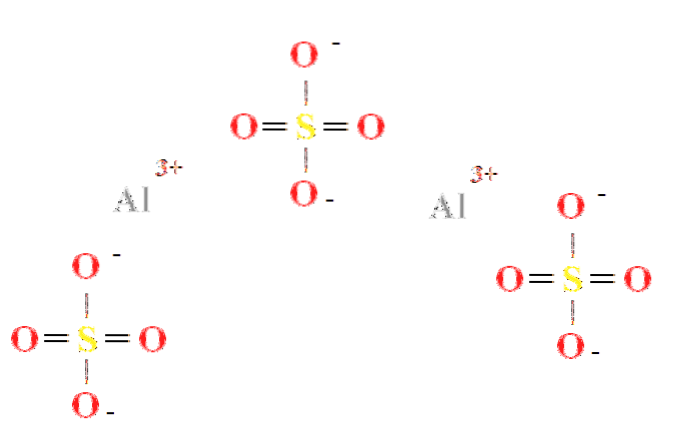
Síran hlinitý má poměr dvou kationtů Al3+ pro každé tři SO anionty4dva- (horní obrázek), který lze vidět přímo v jeho chemickém vzorci Aldva(SW4)3.
Všimněte si, že Al3+ jsou šedivé barvy, zatímco SO4dva- jsou žluté (pro atom síry) a červené (pro atomy kyslíku).
Znázorněná struktura odpovídá bezvodé formě Aldva(SW4)3, protože žádná molekula vody neinteraguje s ionty. Ve svých hydrátech však může vodu přitahovat pozitivní centra Al3+, nebo záporným čtyřstěnem SO4dva- vodíkovou vazbou (HOH-O-SO3dva-).
Aldva(SW4)3∙ 18HdvaNebo například obsahuje 18 molekul vody ve své pevné struktuře. Někteří z nich mohou být v přímém kontaktu s Al3+ nebo s SO4dva-. Jinými slovy: síran hlinitý může mít vnitřní nebo vnější koordinační vodu.
Stejně tak jeho struktura může hostit další kationty, jako je Fe3+, Na+, K.+, atd. K tomu je však nutná přítomnost více aniontů SO4dva-. Aby? Pro neutralizaci nárůstu kladných nábojů v důsledku kovových nečistot.
Síran hlinitý může mít mnoho struktur, ačkoli jeho hydráty mají tendenci přijímat monoklinický krystalický systém.
Fyzikální a chemické vlastnosti
Vzhled
Vypadá jako pevná látka s lesklými bílými krystaly, granulemi nebo práškem.
Molekulární váha
342,31 g / mol (bezvodý).
Zápach
Je bez zápachu
Chuť
Mírně svíravá sladká chuť.
Bod tání
770 ° C bezvodá forma (forma 86,5 ° C oktadekahydrát)
Rozpustnost ve vodě
31,2 g / 100 ml při 0 ° C; 36,4 g / 100 ml při 20 ° C a 89 g / 100 ml při 100 ° C.
Hustota
2,67 až 2,71 g / cm3.
Rozpustnost
Mírně rozpustný v ethylalkoholu.
Tlak páry
V zásadě nula.
Stabilita
Stabilní na vzduchu.
Rozklad
Při zahřátí, přibližně na svůj bod tání, se může rozložit a emitovat zejména oxid siřičitý, toxický plyn..
Žíravost
Roztoky síranu hlinitého jsou korozivní pro hliník. Podobně může sloučenina za přítomnosti vlhkosti korodovat kovy..
pKa
3,3 až 3,6. A jeho pH je 2,9 nebo více v 5% vodném roztoku.
K čemu je (použití)
Srážení nebo vločkování vody
-Při smíchání s vodou (pitnou, servírovanou nebo odpadovou) vytváří síran hlinitý hydroxid hlinitý, který vytváří komplexy se sloučeninami a částicemi v roztoku, což urychluje jejich sedimentaci, což by při absenci úpravy síranem hlinitým trvalo dlouho..
-Síran hlinitý se také používá k čištění vody v bazénu, což zvyšuje jeho atraktivitu..
-Použitím síranu hlinitého se dosáhne vody bez zákalu a barvy, což zvýší její účinnost usnadněním čištění vody. Bohužel tato metoda čištění může vést k mírně zvýšené koncentraci hliníku ve vodě..
-Hliník je velmi toxický kov, který se hromadí v kůži, mozku a plicích a způsobuje vážné poruchy. Kromě toho není známo, jakou funkci plní v živých bytostech..
-Evropská unie požaduje, aby maximální přípustný limit pro hliník ve vodě nepřekročil 0,2 mg / l. Americká agentura pro ochranu životního prostředí mezitím vyžaduje, aby maximální limit kontaminace vody hliníkem nepřekročil 0,05-0,2 mg / l.
-Úprava odpadních vod nebo odpadních vod síranem hlinitým umožňuje ekonomicky eliminovat nebo redukovat fosfor v nich.
Použití jako inkoustové mořidlo a při výrobě papíru
-Síran hlinitý byl použit jako mořidlo v barvivech nebo inkoustech, což pomáhá fixovat na barvený materiál. Jeho fixační účinek je způsoben Al (OH)3, jehož želatinová konzistence spolupracuje s adsorpcí barviv na textil.
-Ačkoli se pro popsaný účel používá přibližně od roku 2 000 př. N. L., Pouze organická barviva vyžadují mořidla. Naproti tomu syntetická barviva nevyžadují, aby mořidla plnila svou funkci..
-Byl přemístěn z výroby papíru, ale stále se používá při výrobě papírenské buničiny. Odstraňuje jeho nečistoty a také se používá k vázání materiálů, neutralizaci nábojů a kalibraci kalafuny..
Průmyslové použití
-Používá se ve stavebnictví k urychlení tuhnutí betonu. Dále se používá při hydroizolaci konstrukcí.
-V průmyslu mýdla a mastnoty se používá při výrobě glycerinu.
-Používá se v ropném průmyslu při výrobě syntetických katalyzátorů, které používají během svého provozu..
-Používá se ve farmaceutickém průmyslu jako adstringent při přípravě léků a kosmetiky.
-Podílí se na zpracování barviv, jako je karmín. Používá se také jako barvivo při výrobě styrenbutadienových syntetických kaučuků..
-V odvětví výroby cukru se používá jako čistič melasy z cukrové třtiny.
-Používá se při výrobě deodorantů. Proč? Protože způsobuje zúžení kanálků potní žlázy, čímž omezuje hromadění potu, což je nezbytné médium pro růst bakterií způsobujících zápach..
-Používá se při činění kůže, což je proces nezbytný pro její použití. Dále se používá při výrobě hnojiv.
-Používá se jako přísada při výrobě barev, lepidel a tmelů, čisticích prostředků a péče o nábytek.
Léčebné a terapeutické použití
-Síran hlinitý je imunitní adjuvans. Proto plní funkci zpracování antigenů takovým způsobem, že když se uvolní v místě působení, produkují větší produkci protilátek pro antigeny, které byly naočkovány..
-Freundovo adjuvans a BCG, stejně jako další adjuvancia, včetně endogenních, jako jsou interleukiny, jsou pro antigeny nespecifické, což umožňuje zvýšení poloměru imunitní akce. To umožnilo vývoj vakcín proti řadě nemocí.
-Koagulační účinek síranu hlinitého umožnilo eliminaci mnoha virů v upravené vodě, mimo jiné: Q beta, MS2, T4 a P1. Výsledky ukazují, že úprava vody síranem hlinitým vede k deaktivaci těchto virů..
-Síran hlinitý se používá ve formě tyčinek nebo jako prášek při léčbě drobných povrchových ran nebo odřenin způsobených holením..
-Používá se při výrobě octanu hlinitého, sloučeniny používané při léčbě některých onemocnění uší. Bez významného úspěchu se také používá ke zmírnění následků bodnutí mravenci..
-Roztoky síranu hlinitého se používají v koncentraci 5% až 10% při lokální léčbě vředů, které umožňují kontrolu jejich sekrece.
-Stahující účinek síranu hlinitého stahuje povrchové vrstvy pokožky, srážení bílkovin a hojení ran.
Jiná použití
-Síran hlinitý pomáhá kontrolovat nadměrný růst řas v rybnících, jezerech a potokech. Používá se také k eliminaci měkkýšů, mj. Španělského slimáka.
-Zahradníci aplikují tuto sloučeninu na okyselení alkalických půd. Při kontaktu s vodou se síran hlinitý rozkládá na hydroxid hlinitý a zředěnou kyselinu sírovou. Poté se vysráží hydroxid hlinitý, přičemž kyselina sírová zůstane v roztoku..
-Okyselování půd působením kyseliny sírové je vizualizováno velmi kreativně, kvůli existenci rostliny zvané Hydrangea, jejíž květy v přítomnosti kyselé půdy modří; to znamená, že jsou citlivé a reagují na změny pH.
-Síran hlinitý se podílí na výrobě pěny pro hašení a řízení požáru. Jak? Reaguje s hydrogenuhličitanem sodným a způsobuje uvolňování COdva. Tento plyn blokuje přístup Odva na místo spalování materiálu; a následně i zastavení palby.
Výroba síranu hlinitého
Síran hlinitý se syntetizuje reakcí sloučeniny bohaté na hliník, jako je minerál bauxit, s kyselinou sírovou při zvýšených teplotách. Následující chemická rovnice představuje reakci:
DodvaNEBO3 + HdvaSW4 -> Aldva(SW4)3 + 3 HdvaNEBO
Síran hlinitý lze také vytvořit neutralizační reakcí mezi hydroxidem hlinitým a kyselinou sírovou podle následující reakce:
2 Al (OH)3 + 3 HdvaSW4 + 12 hdvaO -> Aldva(SW4)3.18HdvaNEBO
Kyselina sírová reaguje s hliníkem za vzniku síranu amonného a uvolňuje molekuly vodíku jako plyn. Reakce je popsána následovně:
2 Al + 3 HdvaSW4 -> Aldva(SW4)3 + 3 Hdva
Typy
Síran hlinitý se dělí na dva typy: typ A a typ B. U síranu hlinitého typu A jsou pevné látky bílé barvy a mají koncentraci železa nižší než 0,5%.
U síranu hlinitého typu B jsou pevné látky hnědé barvy a mají koncentraci železa nižší než 1,5%.
Existují průmyslová odvětví, která vyrábějí síran hlinitý a mají pro jeho klasifikaci různá kritéria. Průmysl tedy uvádí pro svou přípravu síranu hlinitého typu A maximální koncentraci 0,1% železa jako oxidu železitého. Zatímco u typu B udávají maximální koncentraci železa 0,35%.
Toxicita
-Síran hlinitý je sloučenina, která působí toxicky při kontaktu s prachem, což způsobuje podráždění kůže a v případě častého kontaktu dermatitidu..
-V očích způsobuje silné podráždění, dokonce způsobuje trvalé zranění.
-Vdechování způsobuje podráždění nosu a krku, což může způsobit kašel a drsné pocity.
-Jeho požití způsobuje podráždění žaludku, nevolnost a zvracení.
-Existují toxické účinky, které nejsou přímo způsobeny síranem hlinitým, ale jsou nepřímo způsobeny jeho použitím. To je případ určitých toxických účinků hliníku způsobených použitím síranu hlinitého při čištění vody..
-Pacienti, kteří jsou chronicky dialyzovaní pomocí solí připravených ve vyčištěné vodě pomocí síranu hlinitého, pociťují velmi závažné zdravotní poruchy. Mezi těmito poruchami máme anémii, dialyzační demenci a nárůst kostních onemocnění.
Reference
- Wikipedia. (2018). Síran hlinitý. Převzato z: en.wikipedia.org
- Aris Industrial. Roztok síranu hlinitého typu A a B. Převzato z: aris.com.pe
- Christopher Boyd. (9. června 2014). Nejlepší průmyslová využití pro síran hlinitý. Převzato z: chemservice.com
- PubChem. (2018). Síran hlinitý bezvodý. Převzato z: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals. (20. srpna 2009). Bezpečnostní list síranu hlinitého. [PDF]. Převzato z: andesia.com
- Chemická kniha. (2017). Síran hlinitý. Převzato z: chemicalbook.com

Zatím žádné komentáře