
Struktura síranu železnatého (FeSO4), vlastnosti, syntéza

The Síran železitý je anorganická sůl, jejíž chemický vzorec je FeSO4. Skládá se z krystalické pevné látky proměnlivé barvy, která se průmyslově získává jako vedlejší produkt při zpracování oceli..
Vyskytuje se v přírodě v různých formách, nejběžnější je heptahydrát síranu železnatého, FeSO47HdvaO („zelený vitriol“ přítomný v minerálu melenterit). Tento hydrát se snadno vyznačuje modrozelenou barvou jeho krystalů (spodní obrázek). Ostatní hydráty mají obecný vzorec FeSO4XHdvaNebo, kde x se pohybuje od 1 do 7.

Heptahydrát síranu železnatého ztrácí při zahřívání molekuly vody a může být přeměněn na jiné formy síranu železnatého; při zahřátí na 57 ° C tak ztrácí tři molekuly vody a přeměňuje se na tetrahydrát síranu železnatého. O kolik jich můžete celkem přijít? Sedm molekul vody, tedy příliš mnoho vody.
Síran železnatý se používá k léčbě a prevenci anémie z nedostatku železa. Může však mít toxické účinky, takže při jeho dávkování musíte být opatrní.
Na druhou stranu má tato železná sůl řadu použití a aplikací, které zahrnují barvení textilního materiálu a kůže; chemické redukční činidlo; radiační dozimetr; prostředek na ochranu dřeva. Používá se také při prevenci chlorózy u rostlin a při gravírování a litografických procesech..
FeSO4 může na vzduchu oxidovat na síran železnatý, Fedva(SW4)3 rychlostí, kterou lze zvýšit teplotou, světlem nebo zvýšením pH.
Mnoho fyzikálních a chemických vlastností síranu železnatého, jako je rozpustnost ve vodě, teplota tání, typ krystalů, které tvoří, a hustota, závisí na počtu molekul vody zabudovaných do krystalů; tj. jeho hydrátů.
Rejstřík článků
- 1 Struktura síranu železa
- 1.1 Kyselost
- 2 Fyzikální a chemické vlastnosti
- 2.1 Jména
- 2.2 Molekulární vzorec
- 2.3 Molekulová hmotnost
- 2.4 Fyzický vzhled
- 2.5 Zápach
- 2.6 Hustota
- 2.7 Teplota tání
- 2.8 Rozpustnost ve vodě
- 2.9 Rozpustnost v alkoholu
- 2.10 Tlak par
- 2.11 Index lomu
- 2.12 Stabilita
- 2.13 Rozklad
- 2.14 Reakce
- 3 Syntéza
- 3.1 Z ocelové vlny
- 3.2 Od pyritu
- 4 Rizika
- 5 použití
- 5.1 V zemědělství
- 5.2 Jako činidlo a v průmyslu
- 5.3 V medicíně a pro obohacení potravin
- 5.4 Ostatní
- 6 Reference
Struktura síranu železa
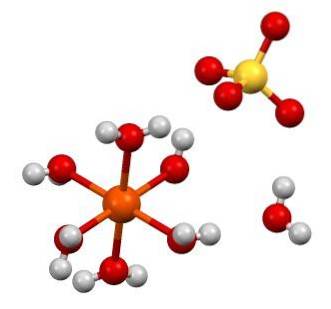
Chemický vzorec FeSO4 zdůrazňuje, že tato sůl je složena z iontů Fedva+ A tak4dva- v poměru 1: 1. Oba ionty interagují prostřednictvím elektrostatických sil takovým způsobem, že jsou uspořádány v ortorombické krystalové soustavě; což logicky odpovídá bezvodé soli.
Na horním obrázku je naopak znázorněna struktura FeSO47HdvaO. Oranžová koule představuje Fe kationdva+, který, jak je vidět, koordinuje se šesti molekulami vody za vzniku osmistěnu. Břemeno vírydva+ přitahuje anion SO4dva-, a to zase, je-li pozorováno, tvoří vodíkovou vazbu se sedmou molekulou vody.
Sedmá molekula vody (ta, která je vzdálená od osmistěnu), také tvoří další vodíkovou vazbu s další molekulou vody patřící sousednímu oktaedronu. Výsledkem těchto interakcí je, že se krystal mění z ortorombického na monoklinický..
Jako krystaly FeSO4 bezvodý hydrát, anionty SO4dva- kolem vírydva+ jsou nahrazeny molekulami H.dvaO. Tyto substituce narušují elektrony d železo, které je nutí procházet různými úrovněmi energie; které jsou zodpovědné za barevné změny mezi bílou, modrozelenou.
Kyselost
Některé SO anionty4dva- mohou být protonovány jako produkt kyselého prostředí. V důsledku toho uvnitř krystalů FeSO47HdvaNebo mohou existovat molekuly HdvaSW4 pokud je pH velmi kyselé; a proto dotek těchto krásných krystalů za takových podmínek může způsobit vážné popáleniny..
Fyzikální a chemické vlastnosti
Jména
Síran železnatý nebo síran železnatý
Molekulární vzorec
-Bezvodý síran železnatý (FeSO4)
-Síran železnatý heptahydrát (FeSO4.7HdvaNEBO)
Molekulární váha
Liší se podle stupně hydratace síranu. Například heptahydrát síranu železitého má molekulovou hmotnost 278,02 g / mol; zatímco bezvodý má molekulovou hmotnost 151,91 g / mol.
Fyzický vzhled
Liší se také podle stupně hydratace. Například bezvodá forma má bílé ortorombické krystaly; zatímco v heptahydrické formě jsou krystaly jednoklikové modrozelené.
Zápach
Toaleta
Hustota
Bezvodý síran železnatý je nejhustší solí (3,65 g / cm)3). Forma heptahydrátu je naopak nejméně hustá (1,895 g / cm)3).
Bod tání
Podobně se to liší v závislosti na stupni hydratace. Bezvodá forma má teplotu tání 680 ° C (1 856 ° F, 973 K) a forma heptahydrátu, 60 - 64 ° C (140 - 147 ° F, 333 - 337 K).
Rozpustnost ve vodě
-Monohydrátová forma: 44,69 g / 100 ml vody (77 ° C)
-Heptahydrát ve formě 51,35 g / 100 ml vody (54 ° C).
Rozpustnost v alkoholu
Nerozpustný.
Tlak páry
1,95 kPa (forma heptahydrátu)
Index lomu
1591 (monohydrát) a 1471 (heptahydrát).
Stabilita
Na vzduchu může rychle oxidovat a je pokryto žlutohnědou barvou, což naznačuje přítomnost kationtu Fe.3+. Rychlost oxidace se zvyšuje přidáním zásady nebo vystavením světlu..
Rozklad
Při zahřátí na rozklad emituje toxické výpary oxidu siřičitého a oxidu siřičitého a zanechává jako zbytek načervenalý oxid železitý..
Reakce
Jedná se o redukční činidlo, které působí na kyselinu dusičnou a redukuje ji na oxid dusnatý. Podobně redukuje chlor na chlorid a toxické formy chromu přítomné v cementu na chrom (III) mají menší toxicitu.
Syntéza
Z ocelové vlny
Síran železnatý se vyrábí reakcí oceli (Fe) s kyselinou sírovou. U popsané metody se postupuje podle následujícího postupu: ocel se používá ve formě ocelové vlny, která se předem odmašťuje acetonem..
Ocelová vlna se poté vloží do skleněné kádinky a úplně se pokryje 30-40% kyselinou sírovou, což umožňuje trávení kyselinou po dobu několika hodin; dokud ocelová vlna nezmizí. Lze přidat více ocelové vlny a postup opakovat několikrát.
Zelené krystaly, které se mohly vytvořit, se znovu rozpustí za použití vody okyselené na pH 1 až 2 kyselinou sírovou. Tento roztok se filtruje na filtračním papíru a pH se upraví přidáním uhličitanu sodného. Roztok se skladuje, aby se zabránilo jeho kontaktu s kyslíkem, a tím se odrazuje od oxidace Fedva+ víře3+
Následně se filtrát podrobí odpařování při teplotě mezi 80-90 ° C. Postup se provádí v kapslích Pietri umístěných na vyhřívací desce. Poté se shromáždí vytvořené zelené krystaly, které lze odvést do exsikátoru k dokončení jejich dehydratace..
Od pyritu
Síran železnatý se také vyrábí oxidací pyritu (FeSdva).
2 FeSdva + 7 O.dva + 2 hdvaO => 2 FeSO4 + 2 hdvaSW4
Rizika
Vdechování FeSO4 způsobuje podráždění nosu, krku a plic. Při fyzickém kontaktu s touto solí může způsobit podráždění kůže a očí; Dlouhodobý kontakt s nimi může navíc způsobit nahnědlou skvrnu a poškození očí..
Opakovaný příjem může způsobit nevolnost, zvracení, bolesti žaludku, zácpu a nepravidelné pohyby střev..
Mezi příznaky otravy síranem železnatým patří: černá nebo krvavá stolice; namodralá kůže a nehty; změny objemu vylučovaného moči; mdloby; sucho v ústech nebo očích; bolest na hrudi; jíst; dýchací obtíže.
Kromě toho se mohou objevit rychlé a nepravidelné srdeční rytmy, zvýšená žízeň a hlad, neobvyklá bledost a dušnost..
Změněná koagulace je známkou otravy síranem železnatým, přičemž je pozorováno prodloužení trombinu, protrombinu a částečné doby tromboplastinu..
Studie provedené na vlivu síranu železnatého na izolované svaly srdce králíků umožnily pozorovat, že způsobil snížení maximálního napětí vyvinutého studovanými srdečními svaly a také maximální rychlost vývoje napětí.
Aplikace
V zemědělství
-Používá se jako pesticid k potlačení a rozpadu ovocných stromů.
-Používá se při léčbě chlorózy, onemocnění charakterizovaného nažloutlou barvou listů způsobenou zásaditostí půd..
-Síran železnatý řídí zásaditost a snižuje pH půdy.
- Odstraňuje mech a upravuje trávník.
Jako činidlo a v průmyslu
V rámci použití FeSO4 jako činidlo a v průmyslu existují následující:
-Analytické činidlo
-Surovina pro získání feritu a magnetického oxidu železa
-Přísada pro výrobu anorganického modrého pigmentu
-Činidlo redukující kyselinu dusičnou, chlor a chrom
-Při výrobě dalších síranů
-Používá se v lázních pro galvanické pokovování železem
-Konzervační prostředek na dřevo
-V hliníkových leptech
-Kvalitativní analýza dusičnanů (hnědožlutý test oxidací Fedva+)
-Polymerační katalyzátor
-Používá se jako předzvěst syntézy jiných žehliček
-Průmyslově se používá jako fixátor skvrn
-Při výrobě barviva na železo
-Mořidlo ve vlnění
-Aby javorové dřevo získalo stříbrnou barvu
-Železný katalyzátor ve Fentonově reakci
V medicíně a pro obohacení potravin
Používá se při léčbě anémie způsobené nedostatkem železa pomocí dávky 150-300 mg síranu železnatého třikrát denně, což způsobí znatelné zvýšení koncentrace hemoglobinu během jednoho týdne léčby..
Rovněž se doporučuje pro použití u těhotných žen jako doplněk jejich stravy. Síran železnatý se používá jako adstringens při hojení ran u skotu..
Ostatní
Používá se při čištění odpadních vod flokulací a také k eliminaci fosfátů z těchto vod. Heptahydrát síranu železnatého se používá k identifikaci druhů hub.
Reference
- CR Scientific. (s.f.). Laboratorní příprava síranu železnatého. Obnoveno z: crscientific.com
- Werner H. Baur. (1964). Na chemii krystalů solí se hydráty. III. Stanovení krystalové struktury FeSO4.7HdvaNebo (melanterit). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). Síran železnatý heptahydrát. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19. prosince 2014). Co je síran železnatý (Feosol)? Každé zdraví. Obnoveno z: everydayhealth.com
- Wikipedia. (2019). Síran železnatý. Obnoveno z: en.wikipedia.org



Zatím žádné komentáře