
Struktura síranu draselného (K2SO4), vlastnosti, použití, syntéza

The síran draselný je bílá nebo bezbarvá anorganická sůl, jejíž chemický vzorec je K.dvaSW4. To bylo známé již ve čtrnáctém století a v sedmnáctém století se tomu říkalo jako sůl duplicatum, protože se jedná o kombinaci kyselé a alkalické soli..
Síran draselný se nachází v minerální formě v arkanitu, ale jeho prezentace je častější u takzvaných Stassfurtských solí. Jedná se o kokrystalizace síranů draselných, hořečnatých, vápenatých a sodných, které lze pozorovat v minerálech, jako je leonit a polyhalit..

Síran draselný je málo toxická sůl a podráždění způsobuje pouze při kontaktu s očima, dýchacími cestami nebo zažívacím traktem. Neexistují žádné důkazy o karcinogenním nebo mutagenním účinku.
Síran draselný se používá jako hnojivo, zejména u plodin, které jsou citlivé na chloridy; takový je případ tabáku a brambor. Tato sloučenina poskytuje draslík, jednu ze tří hlavních živin v rostlinách, a síru, která je přítomna v jejich bílkovinách..
Rejstřík článků
- 1 Struktura
- 1.1 Krystalické fáze
- 1.2 Ionová spleť
- 2 Fyzikální a chemické vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Fyzický vzhled
- 2.4 Hustota
- 2.5 Teplota tání
- 2.6 Bod varu
- 2.7 Rozpustnost ve vodě
- 2.8 Rozpustnost v organických rozpouštědlech
- 2.9 Index lomu (nD)
- 2.10 Reaktivita
- 3 Syntéza
- 3.1 První metoda
- 3.2 Druhá metoda
- 3.3 Třetí metoda
- 3.4 Čtvrtá metoda
- 4 použití
- 4.1 Hnojivo
- 4.2 Průmyslové použití a jako surovina
- 4.3 Medicína
- 4.4 Veterinární
- 4.5 Potravinová příchuť
- 4.6 Jiná použití
- 5 Rizika
- 6 Reference
Struktura
Krystalické fáze
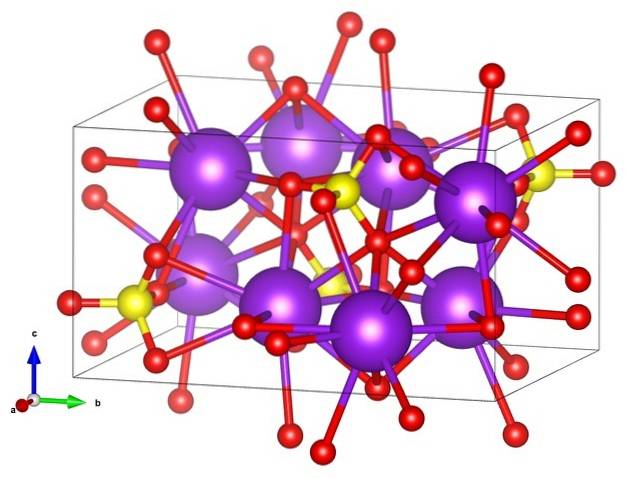
Na prvním obrázku byl ukázán strukturní vzorec síranu draselného. Pro každý anion SO4dva-, čtyřboké geometrie existují dva kationty K+, které mohou být reprezentovány fialovými koulemi (horní obrázek).
Nahoře tedy máme ortorombickou krystalovou strukturu K.dvaSW4, s anionty SO4dva- představované žlutou a červenou koulí; zatímco K kationty+, již bylo řečeno, jsou to fialové koule (trochu robustnější).
Toto znázornění může způsobit zmatek, pokud si myslíte, že sloupce skutečně odpovídají koordinačním spojům. Spíše naznačují, který iont interaguje přímo nebo těsně s jiným kolem něj. Proto se každý kyslík „spojuje“ s pěti K.+ (NEBO3SWdva-- K.+), a to zase s deseti kyslíky z jiných okolních síranových aniontů.
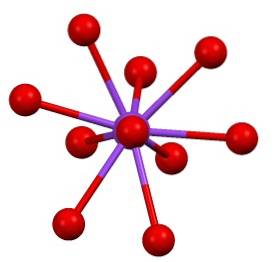
Pak existuje trochu „vzácná“ koordinační sféra pro draslík v K.dvaSW4:
Tato krystalická struktura odpovídá polymorfu p-KdvaSW4. Při zahřátí na 583 ° C dochází k přechodu do fáze α-KdvaSW4, který je šestihranný.
Ion spleť
Určitě struktura K.dvaSW4 je to neobvykle komplikované pro anorganickou sůl. Jeho ionty jsou umístěny a vytvářejí jakousi nesmyslnou spleť a pouhým okem postrádají periodicitu.
Ti, kdo se věnují krystalografii, mohou k této spleti přistupovat vhodnějším a popisnějším způsobem a pozorovat ji ze tří prostorových os.
Všimněte si, že jeho zamotaná struktura by mohla vysvětlit, proč K.dvaSW4 netvoří hydráty: molekuly H.dvaNebo nemají žádný způsob, jak proniknout do krystalové mřížky a hydratovat draselné kationty.
Také s tolika interakcemi obsaženými v iontové spleti lze očekávat, že tato krystalová mřížka bude mít docela stabilitu proti teplu; a ve skutečnosti tomu tak je, protože teplota tání K.dvaSW4 je 1 069 ° C, což ukazuje, že jeho ionty jsou silně soudržné.
Fyzikální a chemické vlastnosti

Jména
-Síran draselný
-Síran potašový
-Arkanit
-Síra potaš
Molární hmotnost
174,259 g / mol
Fyzický vzhled
Bílá krystalická pevná látka, granule nebo prášek s hořkou chutí, bez zápachu.
Hustota
2,66 g / cm3
Bod tání
1 069 ° C
Bod varu
1 689 ° C
Rozpustnost ve vodě
111 g / L při 20 ° C
120 g / l při 25 ° C
240 g / l při 100 ° C
Rozpustnost ve vodě klesá v důsledku přítomnosti chloridu draselného, KCl nebo síranu amonného (NH4)dvaSW4, kvůli společnému iontovému efektu.
Rozpustnost v organických rozpouštědlech
Mírně rozpustný v glycerolu, ale nerozpustný v acetonu a sirníku uhlíku.
Index lomu (nD)
1495
Reaktivita
Síran draselný může reagovat s kyselinou sírovou a okyselit za vzniku hydrogensíranu draselného (KHSO4). Může být redukován při vysokých teplotách na sirník draselný (K.dvaS).
Syntéza
První metoda
Síran draselný se syntetizuje reakcí chloridu draselného s kyselinou sírovou. Syntéza síranu draselného probíhá ve dvou krocích. První krok zahrnuje tvorbu hydrogensíranu draselného.
Jedná se o exotermickou reakci, protože uvolňuje teplo, a proto nevyžaduje externí dodávku tepla. Reakce se provádí při teplotě místnosti.
KCl + HdvaSW4 => HCl + KHSO4
Druhý krok reakce je endotermický, to znamená, že vyžaduje dodávku tepla, aby k němu mohlo dojít.
KCl + KHSO4 => HCl + K.dvaSW4
Druhá metoda
Síran draselný lze syntetizovat neutralizační reakcí kyseliny sírové se zásadou, hydroxidem draselným:
HdvaSW4 + 2 KOH => K.dvaSW4 + 2 hdvaNEBO
Třetí metoda
Síran draselný se vyrábí reakcí oxidu siřičitého, kyslíku, chloridu draselného a vody.
Čtvrtá metoda
Síran draselný se vyrábí extrakcí síranu draselného přítomného ve slaném nálevu z povodí Loop Nur v Číně. Síran draselný se oddělí od nerozpustných složek solanky přidáním okyselující sloučeniny tripolyfosforečnan sodný / fosforečnan močoviny.
Tato sloučenina zvyšuje rozdíl mezi rozpustností síranu draselného a rozpustností jiných méně rozpustných sloučenin, přičemž podle tvůrců metody dosahuje 100% čistého síranu draselného. V užším slova smyslu nejde o metodu syntézy, ale o novou extrakční metodu.
Aplikace
Hnojivo

Jeho hlavní aplikací je použití síranu draselného jako hnojiva. K tomuto účelu se využívá 90% jeho celkové produkce. Jeho použití je preferováno před použitím chloridu draselného v těch plodinách, které jsou citlivé na přítomnost chloridu v půdě; například tabák.
Síran draselný má obsah draslíku 40-44%, zatímco jeho koncentrace síry představuje 17-18% sloučeniny. Draslík je nezbytný pro výkon mnoha základních funkcí rostlin, protože aktivuje enzymatické reakce, syntézu bílkovin, tvorbu škrobu atd..
Kromě toho se draslík podílí na regulaci průtoku vody v listech. Síra je nezbytná pro syntézu bílkovin, protože je přítomna v aminokyselinách, které ji obsahují; takový je případ methioninu, cysteinu a cystinu a také zasahuje do enzymatických reakcí.
Dokonce i síran draselný se používá postřikem na listy v částicích síranu draselného menších než 0,015 mm.
Průmyslové použití a jako surovina
Surový síran draselný se používá při výrobě skla a při výrobě kamence a uhličitanu draselného. Používá se jako činidlo při výrobě kosmetiky. Používá se při výrobě piva jako korekční prostředek na vodu.
Lék
Používá se k nápravě závažného poklesu koncentrace draslíku v plazmě (hypokalémie) způsobeného nadměrným užíváním diuretik, které zvyšují vylučování draslíku močí..
Draslík je hlavním intracelulárním iontem excitabilních buněk, včetně buněk srdce. Proto závažné snížení hladiny draslíku v plazmě ohrožuje srdeční funkce a musí být okamžitě upraveno..
Síran draselný má katarzní účinek, to znamená, že podporuje vylučování stolice z tlustého střeva. Z tohoto důvodu se k odstranění tlustého střeva ze stolice před provedením kolonoskopie používá směs síranů draselných, hořečnatých a sodných, což umožňuje lepší vizualizaci tlustého střeva lékařem..
veterinář
Síran draselný se používá ke snížení potřeby methioninu v krmivech pro drůbež. Přítomnost 0,1% síranu draselného v krmivu nosnic je spojena s 5% zvýšením produkce vajec.
Aroma potravin
Jedná se o příchuť, která dodává potravinám hořkou a slanou chuť, která je u některých z nich žádoucí. Kromě toho je třeba poznamenat, že síran draselný má čtyři základní příchutě: sladkost, hořkost, kyselost a slanost..
Slanost, kyselost a hořkost se zvyšují s koncentrací síranu draselného, zatímco sladkost klesá.
Jiná použití
Síran draselný se používá jako pyrotechnika v kombinaci s dusičnanem draselným k vytvoření fialového plamene. Používá se jako bleskový reduktor v dělostřeleckých propulzích.
Kromě toho se používá jako prostředek ke zvýšení viskozity v kosmetických výrobcích, jako jsou pleťové krémy..
Rizika
Síran draselný je málo toxická sloučenina s velmi nízkou letalitou. LD50 pro orální dávku u myší je 6600 mg / kg hmotnosti zvířete, což naznačuje, že je nutná vysoká dávka, která způsobí smrt myši. Stejná hodnota LD50 se vyskytuje u potkanů.
Při zasažení očí může síran draselný způsobit mechanické podráždění. Síran draselný na pokožce způsobuje malé poškození při průmyslové manipulaci..
Při požití může síran draselný způsobit podráždění gastrointestinálního traktu s nevolností, zvracením a průjmem. A nakonec vdechování prachu síranu draselného způsobuje podráždění dýchacích cest..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Síran draselný. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Síran draselný. Databáze PubChem. CID = 24507. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5. července 2018). Síran draselný. Royal Society of Chemistry. Obnoveno z: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (devatenáctset devadesát šest). Témata v chemii fosfátů. World Scientific. Obnoveno z: books.google.co.ve
- Chemická kniha. (2017). Síran draselný. Obnoveno z: chemicalbook.com
- Shoujiang L. a kol. (2019). Čištění a rychlé rozpouštění síranu draselného ve vodných roztocích. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Síran draselný. Obnoveno z: drugbank.ca
- Společnost Mosaic. (2019). Síran draselný. Výživa plodin. Obnoveno z: cropnutrition.com
- Drogy. (2018). Síran sodný, síran draselný a síran hořečnatý (orální). Obnoveno z: drugs.com



Zatím žádné komentáře