
Struktura síranu sodného (Na2SO4), vlastnosti, použití, výroba

The síran sodný je anorganická sůl, jejíž chemický vzorec je NadvaSW4. Skládá se z bílé pevné látky přítomné ve třech formách: bezvodý, heptahydrát (sotva dostupný) a dekahydrát (známý jako Glaubertova sůl); posledně uvedená je nejhojnější formou síranu sodného.
Síran sodný dekahydrát, NadvaSW410HdvaNebo ji objevil v roce 1625 Glaubert ve vodě pramene, který ji díky svým léčivým vlastnostem pojmenoval sal mirabilis (zázračná sůl)..

Síran sodný má řadu aplikací v textilním a papírenském průmyslu, stejně jako při výrobě skla. Jeho použití je rozšířeno na tepelné aplikace, mezi něž patří dodávka okolního tepla a chlazení notebooku..
Síran sodný je sloučenina s nízkou toxicitou a jeho škodlivé účinky jsou hlavně mechanické a nechemické. Z krystalografických důvodů tato sůl, stejně jako její draselný protějšek, K.dvaSW4, má mřížové a polymorfní struktury.
Rejstřík článků
- 1 Struktura
- 1.1 Bezvodá sůl
- 1.2 Dekahydratovaná sůl
- 2 Vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Příchuť
- 2.6 Hustota
- 2.7 Teplota tání
- 2.8 Bod varu
- 2.9 Rozpustnost ve vodě
- 2.10 Index lomu
- 2.11 Stabilita
- 2.12 Rozklad
- 2,13 pH
- 2.14 Reaktivita
- 3 použití
- 3.1 Papírenský průmysl
- 3.2 Čisticí prostředky
- 3.3 Brýle
- 3.4 Textilní průmysl
- 3.5 Lék
- 3.6 Sušicí prostředek
- 3.7 Surovina
- 4 Získání
- 4.1 Těžba těžby
- 4.2 Chemická výroba
- 5 Rizika
- 6 Reference
Struktura
Bezvodá sůl
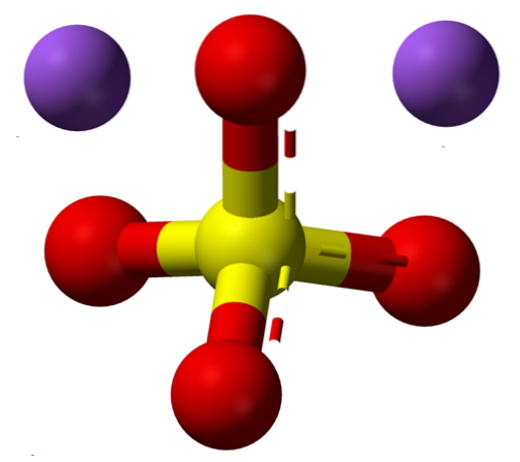
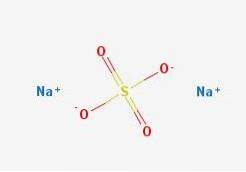
Vzorec NadvaSW4 označuje okamžitě, že ionty Na v krystalech soli+ A tak4dva- jsou v poměru 1: 2; to znamená za každé dva Na kationty+ existuje anion SO4dva- interakce s nimi prostřednictvím elektrostatické přitažlivosti (horní obrázek).
To samozřejmě platí pro NadvaSW4 bezvodý, žádné molekuly vody koordinované se sodíkem v krystalech.
Přestože je to zdánlivě jednoduchá sůl, její popis je strukturálně složitý. PakdvaSW4 představuje polymorfismus, který má až pět krystalických fází: I, II, III, IV a V, jejichž teploty přechodu jsou 180, 200, 228, 235 a 883 ° C.
Ačkoli neexistují žádné odkazy na jeho potvrzení, NadvaSW4Musím být ten s hexagonální krystalickou strukturou, hustší ve srovnání s ortorombickou NadvaSW4III, v jehož krystalech Na+ tvoří čtyřstěn (NaO4) a osmistěn (NaO6) koordinace; to znamená, že může být obklopen čtyřmi nebo šesti anionty SO4dva-.
Decahydrated salt
Mezikontinentální krystalická struktura nejdůležitějšího hydrátu NadvaSW410HdvaNebo je to jednodušší. V něm jsou to prakticky molekuly vody, které interagují nebo koordinují s Na+ v oktaedře Na (HdvaNEBO)6+, s SO4dva- jen poskytuje dostatečnou stabilitu krystalu tak, aby existoval v pevné fázi.
Avšak jeho teplota tání (32,38 ° C), mnohem nižší než teplota bezvodé soli (884 ° C), ukazuje, jak molekuly vody a jejich vodíkové vazby oslabují silnější iontové interakce v NadvaSW4.
Vlastnosti
Jména
-Síran sodný (IUPAC)
-Glauberova sůl (dekahydrát)
-Zázračná sůl (dekahydrát)
-Síran disodný.
Molární hmotnost
142,04 g / mol (bezvodý)
322,20 g / mol (dekahydrát)
Fyzický vzhled
Bílá hygroskopická krystalická pevná látka
Zápach
Toaleta
Chuť
Hořká a slaná
Hustota
2,664 g / cm3 (bezvodý)
1 464 g / cm3 (dekahydrát)
Všimněte si, jak molekuly vody uvnitř krystalů způsobují jejich expanzi, a proto snižují jejich hustotu..
Bod tání
884 ° C (bezvodý)
32,38 ° C (dekahydrát)
Bod varu
1429 ° C (bezvodý)
Rozpustnost ve vodě
4,76 g / 100 ml (0 ° C)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Všechny hodnoty rozpustnosti odpovídají bezvodé soli, která je zcela rozpustná ve vodě za všech teplot..
Rozpustnost se náhle zvyšuje mezi 0 ° C a 38,34 ° C, přičemž se pozoruje, že v tomto teplotním rozmezí se rozpustnost zvyšuje více než 10krát. Od 32,38 ° C je však rozpustnost nezávislá na teplotě..
Stává se, že při teplotě 32,8 ° C se dekahydrát síranu sodného rozpouští ve své vlastní krystalické vodě. Tím se dosáhne rovnováhy mezi dekahydrátovou solí, bezvodou solí a nasyceným roztokem síranu sodného..
Dokud je udržován třífázový stav, teplota zůstane konstantní, což umožňuje kalibraci teploty teploměrů.
Na druhou stranu, rozpustnosti pro heptahydrát jsou:
19,5 g / 100 ml (0 ° C)
44,0 g / 100 ml (20 ° C)
Pamatujte, že při 20 ° C je heptahydrátová sůl třikrát rozpustnější než ta bezvodá..
Index lomu
1468 (bezvodý)
1,394 (dekahydrát)
Stabilita
Stabilní za doporučených skladovacích podmínek. Nekompatibilní se silnými kyselinami a zásadami, hliníkem a hořčíkem.
Rozklad
Při zahřátí na rozklad vydává toxický kouř z oxidu siřičitého a oxidu sodného..
pH
5% vodný roztok má pH 7.
Reaktivita
Síran sodný disociuje ve vodném roztoku na 2 Na+ A tak4dva-, což umožňuje kombinaci síranového iontu s Badva+ k vysrážení síranu barnatého. Prakticky pomáhá vytěsnit barnaté ionty ze vzorků vody.
Síran sodný se převádí na sulfid sodný reakcí při zvýšených teplotách s uhlím:
NadvaSW4 + 2 C => NadvaS + 2 COdva
Glaubertova sůl, NaSO4.10HdvaNebo reaguje s uhličitanem draselným za vzniku uhličitanu sodného.
Aplikace
Papírenský průmysl
Síran sodný se používá při výrobě papírenské buničiny. Používá se při výrobě kraftového papíru, který neobsahuje lignin nebo je podroben bělícímu procesu, který mu dodává velkou odolnost. Kromě toho se používá při výrobě lepenky.
Čistící prostředky
Používá se jako výplňový materiál pro syntetické domácí detergenty a přidává se do detergentu ke snížení povrchového napětí.
Brýle
Používá se při výrobě skla ke snížení nebo eliminaci přítomnosti malých vzduchových bublin v roztaveném skle. Navíc eliminuje tvorbu strusky během procesu rafinace roztaveného skla.
Textilní průmysl
Síran sodný se používá jako mořidlo, protože usnadňuje interakci barviv s vlákny tkanin. Při zkoušce barvivem se používá dekahydrát síranu sodného.
Kromě toho se jako ředidlo barviva a pomocné činidlo pro potisk barviva používá síran sodný; jako jsou přímá barviva, sirná barviva a další látky podporující barvení bavlny. Používá se také jako retardační prostředek pro přímá barviva hedvábí.
Lék
Jako projímadlo se používá dekahydrát síranu sodného, protože je špatně absorbován ve střevě, a proto zůstává v lumen střeva, což způsobuje zvětšení objemu. To stimuluje zvýšení peristaltických kontrakcí, které vyvolávají vypuzení střevního obsahu..
Síran sodný je protijedem proti otravě baryem a solí olova. Glaubertova sůl je účinná při eliminaci určitých nadměrně požitých léků; například paracetamol (acetoaminofen).
Kromě toho se používá k dodávání nedostatečných elektrolytů přítomných v izososmotických roztocích..
Sušicí prostředek
Síran sodný, který je inertním činidlem, se používá k odstranění vody z roztoků organických sloučenin..
Surovina
Síran sodný se používá jako surovina pro výrobu mnoha látek, včetně: sulfidu sodného, uhličitanu sodného a síranu amonného.
Získávání
Síran sodný se získává důlní extrakcí a chemickými reakcemi.
Těžba těžby
Existují tři rudy nebo minerály, které jsou využívány s komerčním výnosem: thenardite (NadvaSW4), mirabilit (NadvaSW410HdvaO) a glaubarit (NadvaSW4·Případ4).
Ve Španělsku jsou ložiska thenarditu a mirabilitu využívána podzemní těžbou galerií a pilířů. Mezitím se glauberit získává na otevřeném prostranství pomocí velkých vorů, které jsou umístěny na ložisku minerálů.
Země je připravena tryskáním s nízkou intenzitou, aby se vytvořila pórovitost, která umožňuje vyluhování síranu sodného. Fáze výroby probíhá zavlažováním postřikovače čerstvou vodou glauberitu, jejíž výluh se šíří směrem dolů..
Oddělí se solanka solanka, přičemž zbytek síranu vápenatého zůstane jako náplň..
Chemická výroba
Síran sodný se získává při výrobě kyseliny chlorovodíkové dvěma způsoby: Mannheimovým procesem a procesem Hardgreaves.
Mannheimský proces
Provádí se ve velkých ocelových pecích a 6 m ocelové reakční plošiny. K reakci dochází mezi chloridem sodným a kyselinou sírovou:
2 NaCl + HdvaSW4 => 2 HCl + NadvaSW4
Proces hardgreaves
Zahrnuje reakci chloridu sodného, oxidu siřičitého, kyslíku a vody:
4 NaCl + 2 SOdva + NEBOdva + 2 hdvaO => 4 HCl + NadvaSW4
Ostatní
Síran sodný se vyrábí při neutralizační reakci mezi hydroxidem sodným a kyselinou sírovou:
2 NaOH + HdvaSW4 => NadvaSW4 + HdvaNEBO
Síran sodný je vedlejším produktem při výrobě mnoha sloučenin. Extrahuje se z kapalného odpadu vypouštěného při výrobě viskózy a celofánu. Také při výrobě dvojchromanu sodného, fenolů, kyseliny borité a karbamátu lithného.
Rizika
Síran sodný je považován za sloučeninu s nízkou toxicitou. Osobě, která jej nesprávně používá, však může způsobit určité škody..
Může například způsobit podráždění očí, zarudnutí a bolest při kontaktu. Na pokožce může u některých lidí způsobit podráždění a alergii. Jeho požití může způsobit podráždění trávicího traktu s nevolností, zvracením a průjmem. A nakonec jeho vdechnutí vyvolá podráždění dýchacích cest.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Síran sodný. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Síran sodný. Databáze PubChem. CID = 24436. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). Krystalová struktura NadvaSW4III. Obnoveno z: rruff-2.geo.arizona.edu
- Glauberit-Thenardit (síran sodný). [PDF]. Obnoveno z: igme.es


Zatím žádné komentáře