
Struktura sulfidu vápenatého (CaS), vlastnosti, výroba, použití

The sulfid vápenatý Je to anorganická pevná látka tvořená prvkem vápník (Ca) a prvkem síra (S), chemický vzorec je CaS. Je to nažloutle bílá pevná látka rozpustná ve vodě, která se v přírodě vyskytuje v některých sopkách a v některých meteoritech ve formě minerálu zvaného oldhamit..
Když se CaS rozpouští ve vodě, vytváří díky sulfidovému iontu S různé sloučeninydva- se stane iontovým SH- a OH ionty jsou tvořeny-. Výsledný roztok je zásaditý. Tato sloučenina se používá jako základ pro sloučeniny, které jsou luminiscenční nebo produkují viditelné světlo za určitých podmínek. Tyto materiály se také používají ve světelných barvách.

CaS byl považován za možný lék k léčbě problémů se srdcem a krevními cévami, jako je hypertenze nebo vysoký krevní tlak, což je onemocnění postihující velkou část světové populace.
Se sulfidem vápenatým lze získat další sloučeniny, jako je dusičnan vápenatý a uhličitan vápenatý. Musí se s ním zacházet opatrně a musí být v kontaktu s vlhkostí atmosféry, která může vytvářet HdvaS, který je velmi toxický.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 4 Chemické vlastnosti
- 4.1 Vodný roztok
- 4.2 Sloučeniny přítomné po rozpuštění ve vodě
- 4.3 Reakce s kyselinami
- 4.4 Další reakce
- 5 Získání
- 5.1 Přítomnost v přírodě
- 6 použití
- 6.1 Ve světelných materiálech
- 6.2 V medicíně
- 6.3 Při získávání dalších sloučenin
- 6.4 Další aplikace
- 7 Rizika
- 8 Reference
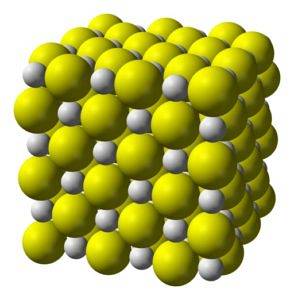
Struktura
Sulfid vápenatý je vysoce iontová sloučenina tvořená iontem vápníku Cadva+ a sulfidový iont Sdva-.
Krystalizuje do kubické struktury jako kamenná sůl.
Nomenklatura
- Sulfid vápenatý
Fyzikální vlastnosti
Fyzický stav
Nažloutle bílá krystalická pevná látka, krychlové krystaly podobné těm z chloridu sodného.
Molekulární váha
72,144 g / mol
Bod tání
2528 ° C
Hustota
2,59 g / cm3
Rozpustnost
Rozpustný ve vodě. Nerozpustný v ethanolu.
Chemické vlastnosti
Vodný roztok
Když se CaS rozpouští ve vodě, rozdělí se na své ionty vápníku Ca. dva+ a síra Sdva-. Ten ve vodě přijímá proton a stává se hydrosulfidovým iontem SH- uvolnění hydroxylového iontu OH-.
Sdva- + HdvaO ⇔ SH- + Ach-
Proto jsou roztoky CaS sulfidu vápenatého zásadité (mají zásadité pH) a neobsahují ionty S.dva- ale SH-.
Teprve když se do roztoku přidá velké množství alkálií, jako je hydroxid sodný, NaOH, dojde k posunu rovnováhy směrem k tvorbě sulfidových iontů Sdva-.

SH- může vzít další proton H+ z vody a tvoří sirovodík, což je velmi toxická sloučenina.
SH- + Hdva⇔ HdvaS + OH-
Z tohoto důvodu se ve vodě tvoří malé množství H.dvaAno, a když je vystaven vlhkosti v prostředí, CaS vydává nepříjemný zápach typický pro sirovodík.
Sloučeniny jsou přítomny po rozpuštění ve vodě
Výsledkem výše uvedených reakcí ve vodě je vznik Ca (SH)dva, Ca (OH)dva a Ca (SH) (OH).
CaS + HdvaO → Ca (SH) (OH)
Ca (SH) (OH) + HdvaO → Ca (OH)dva + HdvaS
Reakce s kyselinami
Stejné reakce, ke kterým dochází ve vodě, způsobují, že CaS reaguje s kyselinami tvořícími HdvaS.
CaS + 2 HCl → CaCldva + HdvaS
Další reakce
Pokud se roztok sirníku vápenatého zahřeje sírou, získají se polysulfidové ionty S.4dva- a S.3dva-.
Pokud se CaS zahřívá na suchém vzduchu nebo v čistém kyslíku, sloučenina oxiduje na siřičitan vápenatý CaSO3 a poté na síran vápenatý CaSO4:
2 CaS + 3 Odva → 2 CaSO3
2 CaSO3 + NEBOdva → 2 CaSO4
S oxidačními činidly, jako je chlorečnan draselný KClO3, dusičnan draselný KNO3 nebo oxid olovičitý PbOdva dochází k prudkým reakcím.
Získávání
Sulfid vápenatý lze připravit kalcinací (zahřátím na velmi vysokou teplotu) prvků vápníku (Ca) a síry (S) v inertní atmosféře, to znamená, že například nejsou přítomny žádný kyslík nebo vodní pára..
Ca + S + teplo → CaS
Lze jej také získat zahřátím síranu vápenatého CaSO4 s dřevěným uhlím:
Případ4 + 2 C → CaS + 2 COdva
V druhém případě se však nezíská čistý CaS, protože reaguje navíc s CaSO4 tvoří CaO a SOdva.
CaS vzniká také spalováním uhlí.
Přítomnost v přírodě
CaS je přirozeně přítomen v minerálu oldhamit. Toto je součást některých meteoritů a je důležité pro vědecký výzkum prováděný na sluneční soustavě..
Předpokládá se, že Oldhamit vznikl kondenzací v mlhovině, z níž vznikla sluneční soustava. Je také přítomen v sopkách.

Kromě toho se sulfid vápenatý přirozeně vyrábí redukcí CaSO4 (sádra) pravděpodobně v důsledku působení bakterií.
Aplikace
Ve světelných materiálech
Jedním z nejrozšířenějších použití sulfidu vápenatého bylo jako základu pro luminiscenční sloučeniny. Jedná se o látky, které za určitých okolností emitují viditelné světlo..
V luminiscenčních sloučeninách CaS působí jako báze a do struktury se přidávají aktivátory, jako jsou chloridy určitých prvků, jako je cer (Ce3+) a europium (Eudva+).
Materiál vzniklý spojením CaS a aktivátoru se používá například v obrazovkách katodových trubic, které tvoří staré obrazovky počítačů nebo počítačů nebo starých televizorů.

Používají se také v současných světelných diodách nebo LED žárovkách. Diody vyzařující světlo).

Tyto materiály se také používají ve světelných barvách a lacích..
V medicíně
Sulfid vápenatý byl v lékařských vědeckých studiích považován za lék k léčbě vysokého krevního tlaku (vysokého tlaku v tepnách). Toto je onemocnění, které postihuje kardiovaskulární systém mnoha lidí (srdce a cévy).
CaS je považován za „dárce“ HdvaTo hraje důležitou roli při regulaci tónu nebo síly krevních cév, takže podávání CaS by mohlo být možným lékem k léčbě hypertenze.

Při získávání dalších sloučenin
Sulfid vápenatý umožňuje přípravu dalších sloučenin, jako je dusičnan vápenatý Ca (NO3)dva:
CaS + 2 HNO3 → Ca (č3)dva + HdvaS
Rovněž se používá k získání uhličitanu vápenatého CaCO3. K tomu se vodný roztok CaS podrobí karbonataci s COdva:
CaS + HdvaO + COdva → HdvaS + CaCO3
Další aplikace
Sulfid vápenatý se také používá jako přísada maziva a jako flotační činidlo při těžbě minerálů..
Rizika
Sulfid vápenatý může způsobit podráždění kůže, očí a dýchacích cest. Musí se s ním zacházet opatrně a s odpovídajícím bezpečnostním vybavením.
Je to velmi toxická sloučenina pro vodní život, takže je pro tato prostředí nebezpečná.
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Lide, D.R. (editor). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Ropp, R.C. (2013). Skupina 16 (O, S, Se, Te) sloučeniny alkalických zemin. Sulfid vápenatý. In Encyclopedia of the Alkaline Earth Compounds. Obnoveno ze sciencedirect.com.
- Li, Y.F. et al. (2009). Sulfid vápenatý (CaS), dárce sirovodíku (H (2) S): nový antihypertenzivum? Med Hypotheses, 2009 září; 73 (3): 445-7. Obnoveno z ncbi.nlm.nih.gov.
- Dům J.E. a dům, K.A. (2016). Síra, selen a telur. Výskyt síry. In Descriptive Anorganic Chemistry (třetí vydání). Obnoveno ze sciencedirect.com.
- NÁS. Národní lékařská knihovna. (2019). Sulfid vápenatý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- De Beer, M. a kol. (2014). Konverze sirníku vápenatého na uhličitan vápenatý během procesu získávání elementární síry ze sádrového odpadu. Waste Manag, 2014 listopad; 34 (11): 2373-81. Obnoveno z ncbi.nlm.nih.gov.


Zatím žádné komentáře