
Struktura, vlastnosti a použití sulfidu zinečnatého (ZnS)
The sulfid zinečnatý je anorganická sloučenina vzorce ZnS, tvořený Zn kationtydva+ a S aniontydva-. V přírodě se vyskytuje hlavně jako dva minerály: wurtzit a sfalerit (nebo směs zinku), přičemž druhá je jeho hlavní forma.
Sfalerit je černé povahy kvůli nečistotám, které obsahuje. Ve své čisté formě má bílé krystaly, zatímco wurtzit má šedobílé krystaly..

Sulfid zinečnatý je nerozpustný ve vodě. Může dojít k poškození životního prostředí, protože proniká do půdy a kontaminuje podzemní vodu a její proudy.
Sulfid zinečnatý lze mimo jiné vyrábět korozí a neutralizací.
Korozí:
Zn + HdvaS => ZnS + Hdva
Neutralizací:
HdvaS + Zn (OH)dva => ZnS + 2HdvaNEBO
Sulfid zinečnatý je fosforeskující sůl, která mu dává kapacitu pro více použití a aplikací. Kromě toho je to polovodič a fotokatalyzátor.
Rejstřík článků
- 1 Struktura
- 1.1 Směs zinku
- 1,2 Wurzita
- 2 Vlastnosti
- 2.1 Barva
- 2.2 Teplota tání
- 2.3 Rozpustnost ve vodě
- 2.4 Rozpustnost
- 2.5 Hustota
- 2.6 Tvrdost
- 2.7 Stabilita
- 2.8 Rozklad
- 3 Názvosloví
- 3.1 Systematické a tradiční názvosloví
- 4 použití
- 4.1 Jako pigmenty nebo nátěry
- 4.2 Kvůli jeho fosforescenci
- 4.3 Polovodič, fotokatalyzátor a katalyzátor
- 5 Reference
Struktura
Sulfid zinečnatý přijímá krystalické struktury řízené elektrostatickými přitažlivostmi mezi kationtem Zndva+ a anion S.dva-. Jsou to dva: sfalerit nebo směs zinku a wurzit. V obou případech ionty minimalizují odpuzování mezi ionty se stejnými náboji..
Směs zinku je nejstabilnější v suchozemských podmínkách tlaku a teploty; a wurzit, který je méně hustý, je výsledkem krystalického přeskupení způsobeného zvýšenou teplotou.
Tyto dvě struktury mohou koexistovat ve stejné pevné látce ZnS současně, i když wurzite bude velmi pomalu dominovat..
Směs zinku

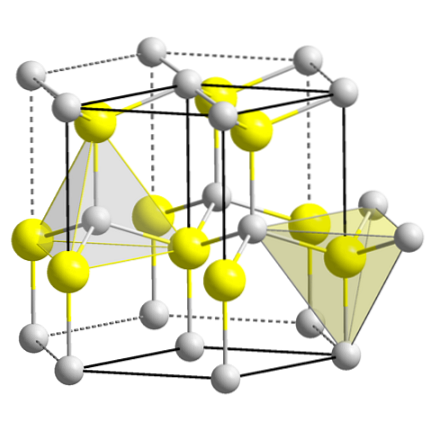
Horní obrázek ukazuje kubickou jednotkovou buňku vycentrovanou na tvářích struktury směsi zinku. Žluté koule odpovídají aniontům S.dva-, a šedé k kationům Zndva+, umístěné v rozích a ve středech ploch krychle.
Všimněte si čtyřboká geometrie kolem iontů. Směs zinku může být také reprezentována těmito čtyřstěnmi, jejichž otvory uvnitř krystalu mají stejnou geometrii (čtyřboké otvory).
Podobně je v jednotkových buňkách splněn podíl ZnS; tj. poměr 1: 1. Tedy pro každý kation Zndva+ existuje anion S.dva-. Na obrázku se může zdát, že šedé koule jsou hojné, ale ve skutečnosti jsou, protože jsou v rozích a ve středu tváří krychle, sdíleny jinými buňkami.
Například pokud vezmete čtyři žluté koule, které jsou uvnitř krabice, „kousky“ všech šedých koulí kolem ní by se měly rovnat (a dělají) čtyři. V kubické jednotce jsou tedy čtyři Zndva+ a čtyři S.dva-, splňující stechiometrický poměr ZnS.
Je také důležité zdůraznit, že před a za žlutými koulemi (prostor, který je od sebe odděluje) jsou čtyřboké díry.
Wurzita
Na rozdíl od struktury směsi zinku přijímá wurzit hexagonální krystalový systém (horní obrázek). To je méně kompaktní, takže pevná látka má nižší hustotu. Ionty ve wurzitu mají také čtyřboké prostředí a poměr 1: 1, který souhlasí se vzorcem ZnS..
Vlastnosti
Barva
Lze jej prezentovat třemi způsoby:
-Wurtzite, s bílými a šestihrannými krystaly.
-Sfalerit se šedavě bílými krystaly a krychlovými krystaly.
-Jako bílý až šedavě bílý nebo nažloutlý prášek a krychlové nažloutlé krystaly.
Bod tání
1700 ° C.
Rozpustnost ve vodě
Prakticky nerozpustný (0,00069 g / 100 ml při 18 ° C).
Rozpustnost
Nerozpustný v zásadách, rozpustný ve zředěných minerálních kyselinách.
Hustota
Sfalerit 4,04 g / cm3 a wurtzite 4,09 g / cm3.
Tvrdost
Má tvrdost 3 až 4 podle Mohsovy stupnice.
Stabilita
Pokud obsahuje vodu, pomalu oxiduje na síran. V suchém prostředí je stabilní.
Rozklad
Při zahřátí na vysoké teploty uvolňuje toxické páry zinku a oxidů síry.
Nomenklatura
Elektronová konfigurace Zn je [Ar] 3d104 sdva. Ztráta dvou elektronů 4s orbitalu zůstává jako kation Zndva+ s vyplněnými d orbitály. Proto, protože elektronicky Zndva+ je mnohem stabilnější než Zn+, má pouze valenci +2.
Proto je u akciové nomenklatury vynechán, přidává se jeho valence v závorkách a s římskými číslicemi: sulfid zinečnatý (II).
Systematické a tradiční názvosloví
Existují však i jiné způsoby, jak zavolat ZnS, kromě již aktivovaného. V systematice je počet atomů každého prvku specifikován řeckými čitateli; s jedinou výjimkou prvku vpravo, když je pouze jeden. Proto je ZnS pojmenován jako: opicesulfid zinečnatý (a ne monosulfid monozinečnatý).
S ohledem na tradiční nomenklaturu se zinek mající jedinou valenci +2 přidává přidáním přípony -ico. Výsledkem je jeho tradiční název: sulfid zinečnatýico.
Aplikace
Jako pigmenty nebo nátěry
-Sachtolith je bílý pigment vyrobený ze sulfidu zinečnatého. Používá se na tmely, tmely, tmely, základní nátěry, latexové barvy a značení.
Jeho použití v kombinaci s pigmenty absorbujícími ultrafialové světlo, jako jsou mikro titanové nebo transparentní pigmenty oxidu železa, je nezbytné u pigmentů odolných vůči povětrnostním vlivům.
-Pokud se ZnS aplikuje na latexové nebo strukturované barvy, má prodloužený mikrobicidní účinek.
-Díky své velké tvrdosti a odolnosti proti rozbití, erozi, dešti nebo prachu je vhodný pro vnější infračervená okna nebo v rámech letadel.
-ZnS se používá k potahování rotorů používaných při transportu sloučenin, aby se snížilo opotřebení. Používá se také při výrobě tiskových barev, izolačních směsí, termoplastické pigmentace, nehořlavých plastů a elektroluminiscenčních lamp..
-Sulfid zinečnatý může být průhledný a může být použit jako okno pro viditelnou optiku a infračervenou optiku. Používá se v zařízeních pro noční vidění, televizních obrazovkách, radarových obrazovkách a fluorescenčních povlacích.
-ZnS s dopingem Cu se používá při výrobě elektroluminiscenčních panelů. Také se používá v raketovém pohonu a gravimetrii.
Pro jeho fosforescenci
-Jeho fosforescence se používá k zabarvení hodinových ručiček a tím k zobrazení času ve tmě; také v barvách na hračky, v nouzových značkách a dopravních varováních.
Fosforescence umožňuje použití sirníku zinečnatého v katodových trubicích a rentgenových obrazovkách k záři v tmavých místech. Barva fosforescence závisí na použitém aktivátoru.
Polovodič, fotokatalyzátor a katalyzátor
-Sfalerit a wurtzit jsou širokopásmové štěrbinové polovodiče. Sfalerit má rozštěp pásma 3,54 eV, zatímco wurtzite má rozštěp pásma 3,91 eV.
-ZnS se používá při přípravě fotokatalyzátoru složeného z CdS - ZnS / zirkonium - fosforečnan titaničitý používaný k výrobě vodíku ve viditelném světle.
-Působí jako katalyzátor odbourávání organických znečišťujících látek. Používá se při přípravě synchronizátoru barev v LED žárovkách.
-Jeho nanokrystaly se používají pro ultracitlivou detekci proteinů. Například vyzařováním světla z kvantových teček ZnS. Používá se při přípravě kombinovaného fotokatalyzátoru (CdS / ZnS) -TiO2 pro elektrickou výrobu pomocí fotoelektrokatalýzy.
Reference
- PubChem. (2018). Síran zinečnatý. Převzato z: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16. ledna). Bílý pigment na bázi sulfidu zinečnatého. Obnoveno z: quiminet.com
- Wikipedia. (2018). Síran zinečnatý. Převzato z: en.wikipedia.org
- II-VI UK. (2015). Sulfid zinečnatý (ZnS). Převzato z: ii-vi.es
- Rob Toreki. (2015, 30. března). Struktura Zincblende (ZnS). Převzato z: ilpi.com
- Chemistry LibreTexts. (22. ledna 2017). Směs struktury a zinku (ZnS). Převzato z: chem.libretexts.org
- Reade. (2018). Sulfid zinečnatý / sulfid zinečnatý (ZnS). Převzato z: reade.com



Zatím žádné komentáře