
Struktura hydroxylové (OH), iontové a funkční skupiny

The hydroxylová skupina (ACH) Je to ten, který má atom kyslíku a připomíná molekulu vody. Lze jej najít jako skupinu, iont nebo radikál (OH·). Ve světě organické chemie tvoří vazbu v podstatě s atomem uhlíku, i když to může také dělat se sírou nebo fosforem.
Na druhé straně se v anorganické chemii účastní jako hydroxylový ion (konkrétněji hydroxid nebo hydroxylový ion). To znamená, že typ vazby mezi ním a kovy není kovalentní, ale iontový nebo koordinační. Z tohoto důvodu je to velmi důležitý „znak“, který definuje vlastnosti a transformace mnoha sloučenin..

Jak je vidět na obrázku výše, skupina OH je spojena s radikálem označeným písmenem R (pokud je to alkyl) nebo písmenem Ar (pokud je aromatický). Aby se nerozlišovalo mezi těmito dvěma, je někdy znázorněno spojené s „vlnou“. Takže podle toho, co je za touto „vlnou“, mluvíme o organické sloučenině nebo o jiné..
Čím skupina OH přispívá k molekule, na kterou se váže? Odpověď spočívá v jejich protonech, které mohou být „popadnuty“ silnými bázemi za vzniku solí; mohou také interagovat s jinými okolními skupinami prostřednictvím vodíkových vazeb. Ať už je kdekoli, představuje potenciální oblast tvořící vodu.
Rejstřík článků
- 1 Struktura
- 1.1 Vodíkové mosty
- 2 Hydroxylový ion
- 3 Dehydratační reakce
- 4 Funkční skupiny
- 4.1 Alkoholy
- 4.2 Fenoly
- 4.3 Karboxylové kyseliny
- 5 Reference
Struktura
Jaká je struktura hydroxylové skupiny? Molekula vody je hranatá; to znamená, že to vypadá jako Bumerang. Pokud „uříznou“ jeden z jeho konců - nebo co je stejné, odstraní proton - mohou nastat dvě situace: radikál (OH·) nebo hydroxylový ion (OH-). Oba však mají molekulární lineární geometrii (ale ne elektronickou).
Je zřejmé, že je to způsobeno skutečností, že jednoduché vazby orientují dva atomy tak, aby zůstaly vyrovnány, ale to samé se neděje u jejich hybridních orbitalů (podle teorie valenčních vazeb).
Na druhou stranu, protože molekula vody je H-O-H a je-li známo, že je úhlová, vznikne při změně H za R nebo Ar R-O-H nebo Ar-O-H. Zde má přesná oblast zahrnující tři atomy úhlovou molekulární geometrii, ale oblast dvou atomů O-H je lineární..
Vodíkové vazby
Skupina OH umožňuje molekulám, které ji mají, vzájemně interagovat prostřednictvím vodíkových vazeb. Samy o sobě nejsou silné, ale s rostoucím počtem OH ve struktuře sloučeniny se jejich účinky znásobují a odrážejí se ve fyzikálních vlastnostech sloučeniny..
Vzhledem k tomu, že tyto můstky vyžadují, aby jejich atomy směřovaly proti sobě, musí atom kyslíku jedné skupiny OH tvořit přímku s vodíkem druhé skupiny..
To vede k velmi specifickým prostorovým uspořádáním, jako jsou ta, která se nacházejí ve struktuře molekuly DNA (mezi dusíkatými bázemi)..
Stejně tak je počet skupin OH ve struktuře přímo úměrný afinitě vody k molekule nebo naopak. Co to znamená? Například cukr má sice hydrofobní uhlíkovou strukturu, ale díky velkému počtu skupin OH je velmi rozpustný ve vodě..
V některých pevných látkách jsou však mezimolekulární interakce tak silné, že „dávají přednost“ tomu, aby zůstaly pohromadě, než aby se rozpustily v určitém rozpouštědle..
Hydroxylový ion
I když jsou iont a hydroxylová skupina velmi podobné, jejich chemické vlastnosti jsou velmi odlišné. Hydroxylový ion je extrémně silná báze; to znamená, že přijímá protony, dokonce i pomocí sil, aby se z nich stala voda.
Proč? Protože se jedná o neúplnou molekulu vody, negativně nabitou a dychtivou po dokončení s přídavkem protonu.
Typická reakce vysvětlující zásaditost tohoto iontu je následující:
R-OH + OH- => R-O- + HdvaNEBO
K tomu dochází, když se do alkoholu přidá zásadité řešení. Zde je alkoxidový iont (RO-) okamžitě se spojí s kladným iontem v roztoku; tj. Na kation+ (Strup).
Protože skupina OH nemusí být protonována, je to extrémně slabá báze, ale jak je vidět na chemické rovnici, může darovat protony, i když jen s velmi silnými bázemi..
Podobně stojí za zmínku nukleofilní povaha OH-. Co to znamená? Jelikož se jedná o velmi malý záporný iont, může rychle cestovat a zaútočit na pozitivní jádra (nikoli atomová jádra).
Tato pozitivní jádra jsou atomy molekuly, které kvůli svému elektronegativnímu prostředí trpí elektronickým nedostatkem..
Dehydratační reakce
OH skupina přijímá protony pouze ve vysoce kyselém prostředí, což vede k následující reakci:
R-OH + H+ => R-OdvaH+
V tomto výrazu H+ je kyselý proton darovaný vysoce kyselým druhem (HdvaSW4, HCl, HI atd.). Zde se vytvoří molekula vody, která je však spojena se zbytkem organické (nebo anorganické) struktury.
Kladný parciální náboj na atomu kyslíku způsobuje oslabení vazby R-OdvaH+, což má za následek uvolňování vody. Z tohoto důvodu je známá jako dehydratační reakce, protože alkoholy v kyselém prostředí uvolňují kapalnou vodu..
Co přijde dál? Tvorba takzvaných alkenů (R.dvaC = CRdva nebo R.dvaC = CHdva).
Funkční skupiny
Alkoholy
Samotná hydroxylová skupina je již funkční skupinou: alkoholy. Příklady tohoto typu sloučeniny jsou ethylalkohol (EtOH) a propanol (CH3CHdvaCHdvaACH).
Jsou to obecně mísitelné kapaliny s vodou, protože mohou vytvářet vodíkové vazby mezi svými molekulami.
Fenoly
Dalším typem alkoholů jsou aromáty (ArOH). Ar znamená arylový radikál, který není nic jiného než benzenový kruh s alkylovými substituenty nebo bez nich.
Aromatičnost těchto alkoholů je činí odolnými vůči útokům kyselých protonů; jinými slovy, nemohou být dehydratovány (pokud je skupina OH přímo připojena ke kruhu).
To je případ fenolu (C.6H5ACH):
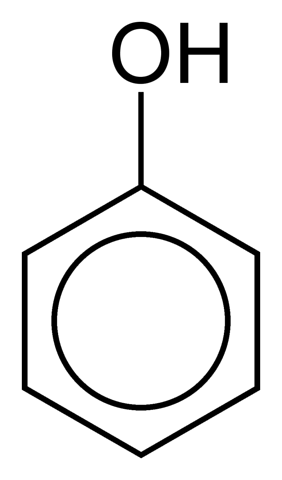
Fenolový kruh může být součástí větší struktury, jako je tomu v aminokyselině tyrosinu.
Karboxylové kyseliny
Nakonec hydroxylová skupina představuje kyselý charakter karboxylové skupiny přítomné v organických kyselinách (-COOH). Zde, na rozdíl od alkoholů nebo fenolů, je OH velmi kyselý a jeho proton je darován silným nebo mírně silným zásadám..
Reference
- Helmenstine, Anne Marie, Ph.D. (7. února 2017). Definice hydroxylové skupiny. Převzato z: thoughtco.com
- Wikipedia. (2018). Hydroxyskupina. Převzato z: en.wikipedia.org
- Projekt biologie. (25. srpna 2003). Hydroxyl aminokyseliny. Katedra biochemie a molekulární biofyziky University of Arizona. Převzato z: biology.arizona.edu
- Dr. J.A. Colapret. Alkoholy. Převzato z: colapret.cm.utexas.edu
- Quimicas.net (2018). Hydroxylová skupina. Obnoveno z: quimicas.net
- Dr. Ian Hunt. Dehydratace alkoholů. Katedra chemie, University of Calgary. Převzato z: chem.ucalgary.ca

Zatím žádné komentáře