
Tvorba kationtů, rozdíly s anionty a příklady

A kation je to chemický druh, který má kladný náboj. Spolu s aniontem tvoří dva typy existujících iontů. Jeho náboj je produktem deficitu elektronů v atomu, což způsobuje větší přitažlivost protonů v jádře. U každého elektronu, který neutrální atom ztratí, se kladný náboj zvýší o jednu jednotku..
Pokud atom ztratí elektron, a proto je počet protonů větší než jeden, pak bude jeho kladný náboj +1; pokud ztratíte dva elektrony, bude náboj +2 atd. Pokud má kationt náboj +1, říká se, že je jednomocný; na druhou stranu, pokud je uvedený náboj větší než +1, říká se, že kation je polyvalentní.
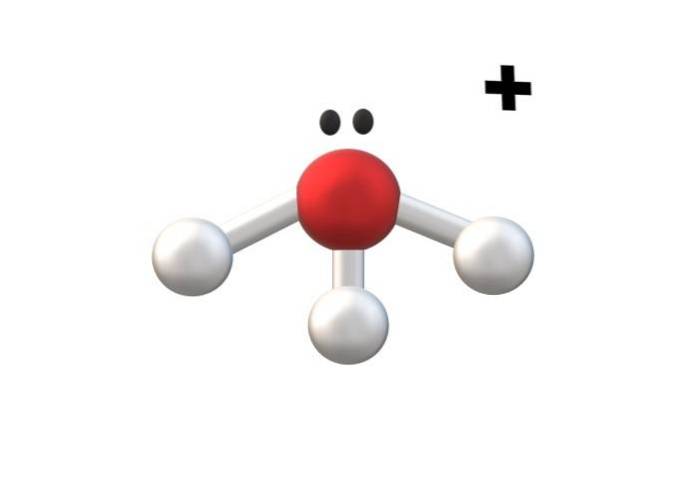
Obrázek výše ukazuje kation H3NEBO+, zvaný hydroniový ion. Jak je vidět, sotva má náboj +1, což je následně monovalentní kation.
Kationty jsou důležitými druhy, protože vyvíjejí elektrostatickou sílu na své prostředí a molekuly kolem nich. Představují vysokou interakci s vodou, kapalinou, která je hydratuje a transportuje ve vlhkých půdách, aby později dosáhly kořenů rostlin a byly použity pro jejich fyziologické funkce..
Rejstřík článků
- 1 Jak se tvoří kation?
- 1.1 Formální poplatky a další odkazy
- 1.2 Oxidace
- 2 Rozdíly s anionty
- 3 Příklady nejběžnějších kationtů
- 3.1 Monatomika
- 3.2 Polyatomika
- 4 Odkazy
Jak se tvoří kation?
Bylo zmíněno, že když atom ztratí elektron, jeho větší počet protonů ve vztahu k elektronům vyvíjí přitažlivou sílu, která se promítne do kladného náboje. Jak ale může dojít ke ztrátě elektronu? Odpověď závisí na transformaci, ke které dochází při chemických reakcích.
Je třeba poznamenat, že přítomnost kladně nabitého atomu nemusí nutně znamenat vznik kationtu. Aby to bylo považováno za takové, nesmí existovat atom se záporným formálním nábojem, který jej neutralizuje. Jinak by ve stejné sloučenině byla přitažlivost a odpor a bylo by to neutrální.
Formální nahrávání a další odkazy
Elektronegativní atomy přitahují elektrony ze svých kovalentních vazeb k nim. I když jsou elektrony sdíleny rovnoměrně, dojde k bodu, kdy budou mít částečně méně elektronů než v jejich základní konfiguraci; to je atom volných atomů, aniž by byl vázán na jiné prvky.
Pak tyto elektronegativní atomy začnou pociťovat nedostatek elektronů a s tím budou protony jejich jader vyvíjet větší přitažlivou sílu; rodí se kladný formální náboj. Pokud existuje pouze jeden pozitivní formální náboj, sloučenina projeví celkový pozitivní iontový náboj; tak se rodí kation.
Atom kyslíku kationtu H3NEBO+ Je to věrný příklad výše uvedeného. Tím, že má tři vazby O-H, jednu více než v molekule vody (H-O-H), prožívá ztrátu elektronu z jeho bazálního stavu. Formální výpočty poplatků vám umožňují určit, kdy k tomu dojde.
Pokud se na chvíli předpokládá tvorba další vazby O-H, získá se dvojmocný kation H4NEBOdva+. Všimněte si, že dvojmocný náboj v horní části kationtu je napsán následovně: číslo následované symbolem „+“; stejným způsobem postupujeme s anionty.
Oxidace
Kovy par formují kationy. Ne všechny však mohou vytvářet kovalentní vazby (nebo alespoň čistě kovalentní vazby). Místo toho ztrácejí elektrony, aby vytvořily iontové vazby: pozitivní náboj přitahuje negativní, držený pohromadě fyzickými silami..
Kovy proto při přechodu z M do M ztrácejí elektronyn+, kde n obvykle se rovná počtu jeho skupiny v periodické tabulce; i kdyby n může nabývat několika celočíselných hodnot, což platí zejména u přechodných kovů. K této ztrátě elektronů dochází v typu chemické reakce nazývané oxidace..
Kovy oxidují, ztrácejí elektron, počet protonů v jejich atomech převyšuje počet elektronů a následně vykazují kladný náboj. Aby došlo k oxidaci, musí existovat oxidační činidlo, které snižuje nebo získává elektrony ztracené kovy. Kyslík je ze všech nejznámější oxidační činidlo.
Rozdíly s anionty
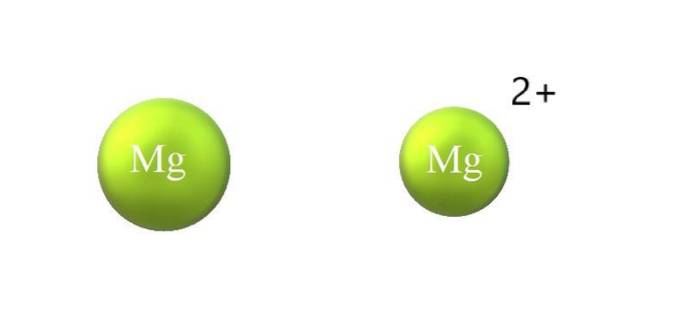
Níže jsou uvedeny rozdíly mezi kationtem a aniontem:
-Kation je obecně menší než anion. Obrázek nahoře ukazuje, jak se poloměr atomu Mg zmenšuje ztrátou dvou elektronů a přeměnou na kation Mg.dva+; u anionů nastává opak: stávají se objemnějšími.
-Má více protonů než elektronů, zatímco anion má více elektronů než protonů..
-Protože je menší, jeho hustota náboje je vyšší, a proto má větší polarizační sílu; to znamená, že deformuje elektronové mraky sousedních atomů.
-Kation se pohybuje ve stejném směru jako aplikované elektrické pole, zatímco anion se pohybuje v opačném směru.
Příklady nejběžnějších kationtů
Monatomické
Monatomické kationty pocházejí většinou z kovů (s určitými výjimkami, jako je H+). Ze zbytku je extrémně vzácné uvažovat o kationu odvozeném od nekovového prvku.
Bude vidět, že mnoho z nich je dvojitých nebo vícemocných a že velikosti jejich nábojů souhlasí s počtem jejich skupin v periodické tabulce..
-Li+
-Na+
-K.+
-Rb+
-Čs+
-Fr.+
-Ag+
Všichni mají společné náboj „1+“, který je psán bez nutnosti uvádět číslo, a také pocházejí ze skupiny 1: alkalické kovy. Kromě toho existuje kation Ag+, jeden z nejběžnějších přechodných kovů.
-Býtdva+
-Mgdva+
-ACdva+
-pandva+
-Badva+
-Radva+
Tyto dvojmocné kationty jsou odvozeny z jejich příslušných kovů patřících do skupiny 2: kovů alkalických zemin..
-Do3+
-Ga3+
-v3+
-Tl3+
-Nh3+
Trojmocné kationty skupiny boru.
Dosud byly příklady charakterizovány jako příklady s jedinou valencí nebo nábojem. Jiné kationty vykazují více než jednu valenci nebo pozitivní oxidační stav:
-Sndva+
-Sn4+ (cín)
-Spoldva+
-Spol3+ (kobalt)
-Au+
-Au3+ (zlato)
-Víradva+
-Víra3+ (žehlička)
A jiné kovy, jako je mangan, mohou mít ještě více valencí:
-Mndva+
-Mn3+
-Mn4+
-Mn7+
Čím vyšší náboj, tím menší a polarizující kation..
Polyatomické
Aniž bychom se věnovali organické chemii, existují anorganické a polyatomové kationty, které jsou v každodenním životě velmi běžné; jako:
-H3NEBO+ (hydronium, již zmíněno).
-NH4+ (amonný).
-NEdva+ (nitronium přítomné v nitračních procesech).
-PH4+ (fosfonium).
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (5. května 2019). Definice kationtu a příklady. Obnoveno z: thoughtco.com
- Wyman Elizabeth. (2019). Kation: Definice a příklady. Studie. Obnoveno z: study.com
- Dummies. (2019). Pozitivní a negativní ionty: kationty a anionty. Obnoveno z: dummies.com
- Wikipedia. (2019). Kation. Obnoveno z: es.wikipedia.org



Zatím žádné komentáře