
Transaminační mechanismus, funkce a příklady
The transaminace je typ chemické reakce, která funguje při „redistribuci“ aminoskupin mezi aminokyselinami, protože zahrnuje reverzibilní aminační procesy (přidání aminoskupiny) a deaminaci (eliminaci aminoskupiny), které jsou katalyzovány specifickými enzymy známými jako transaminázy nebo aminotransferázy.
Obecná transaminační reakce zahrnuje výměnu mezi aminokyselinou a jakoukoli a-keto kyselinou, přičemž výměna aminoskupiny poskytuje ketokyselinovou verzi první aminokyseliny substrátu a aminokyselinovou verzi prvního substrátu a-ketokyseliny..

Aminoskupina, která se obvykle vyměňuje, je "alfa" amino, tj. Ta, která se podílí na tvorbě peptidových vazeb a která definuje strukturu aminokyselin, i když mohou také nastat reakce zahrnující jiné aminoskupiny přítomné v různých pozicích..
S výjimkou lysinu, threoninu, prolinu a hydroxyprolinu se všechny aminokyseliny účastní transaminačních reakcí, ačkoli byly popsány transaminázy pro histidin, serin, methionin a fenylalanin, ale jejich metabolické cesty tento typ reakcí nezahrnují..
Transaminační reakce mezi aminokyselinami a α-ketokyselinami byly objeveny v roce 1937 Braunsteinem a Kritzmannem a od té doby byly předmětem intenzivních studií, protože se vyskytují v mnoha tkáních různých organismů a za různými účely..
Například u lidí jsou transaminázy široce distribuovány v tělesných tkáních a jsou zvláště účinné v srdečních svalových tkáních, játrech, tkáních kosterního svalstva a ledvinách..
Rejstřík článků
- 1 Reakční mechanismus
- 2 Funkce transaminace
- 3 příklady
- 4 Odkazy
Reakční mechanismus
Transaminační reakce zahrnují víceméně stejný mechanismus. Jak bylo diskutováno výše, tyto reakce probíhají jako reverzibilní výměna aminoskupiny mezi aminokyselinou a a-keto kyselinou (deaminovanou), čímž vzniká a-keto kyselina donorové aminokyseliny a aminokyselina a-keto kyseliny receptor..
Tyto reakce závisí na sloučenině známé jako pyridoxal fosfát, derivátu vitaminu B6, který se účastní jako transportér aminoskupin a který se váže na transaminázové enzymy tvorbou Schiffovy báze mezi aldehydovou skupinou této molekuly a ε-amino lysinového zbytku v aktivním místě enzymu.
Vazba mezi pyridoxal fosfátem a lysinovým zbytkem v aktivním místě není kovalentní, ale nastává elektrostatickou interakcí mezi kladným nábojem dusíku na lysinu a záporným nábojem na fosfátové skupině pyridoxalu.
V průběhu reakce aminokyselina, která funguje jako substrát, vytěsňuje ε-aminoskupinu zbytku lysinu v aktivním místě, které se účastní Schiffovy báze s pyridoxalem.
Mezitím se dvojice elektronů z alfa uhlíku aminokyseliny odstraní a přenese se na pyridinový kruh, který tvoří pyridoxal fosfát (kladně nabitý), a poté se „dopraví“ do α-ketokyseliny, která funguje jako druhý substrát..
Tímto způsobem se pyridoxal fosfát podílí nejen na přenosu nebo transportu aminoskupin mezi aminokyselinami a α-ketokyselinami, které jsou substráty transamináz, ale také působí jako „záchyt“ elektronů, což usnadňuje disociaci vodíku alfa aminokyseliny.
Stručně řečeno, první substrát, aminokyselina, přenáší svou aminoskupinu na pyridoxal fosfát, odkud se následně přenáší na druhý substrát, kyselinu α-keto, přičemž mezitím vytváří meziprodukt známou jako pyridoxamin fosfát..
Funkce transaminace
Transaminázové enzymy se obvykle nacházejí v cytosolu a mitochondriích a fungují při integraci různých metabolických drah.
Glutamát dehydrogenáza například ve své reverzní reakci může přeměnit glutamát na amonný, NADH (nebo NADPH) a α-ketoglutarát, který může vstoupit do cyklu trikarboxylové kyseliny a fungovat při výrobě energie.
Tento enzym, který je v mitochondriální matrici, představuje větev, která spojuje aminokyseliny s energetickým metabolismem, takže když buňce chybí dostatek energie ve formě sacharidů nebo tuků, aby mohla fungovat, může alternativně použít některé aminokyseliny pro stejnou účel.
Tvorba enzymu (glutamátdehydrogenáza) během vývoje mozku je nezbytná pro kontrolu detoxikace amonia, protože se ukázalo, že některé případy mentální retardace mají co do činění s nízkou aktivitou, která vede k hromadění amoniaku, což je škodlivé pro zdraví mozku.
V některých jaterních buňkách mohou být transaminační reakce použity také pro syntézu glukózy glukoneogenezí.
Glutamin se přeměňuje na glutamát a amonium pomocí enzymu glutaminázy. Glutamát se poté převede na α-ketoglutarát, který vstupuje do Krebsova cyklu a poté do glukoneogeneze. K tomuto poslednímu kroku dochází díky tomu, že malát, jeden z produktů cesty, je transportován z mitochondrií pomocí raketoplánu..
Tento člun ponechává α-ketoglutarát vydán na milost a nemilost jablečnému enzymu, který jej přeměňuje na pyruvát. Poté mohou být dvě molekuly pyruvátu převedeny na jednu molekulu glukózy pomocí glukoneogeneze..
Příklady
Nejběžnější transaminační reakce se týkají aminokyselin alaninu, kyseliny glutamové a kyseliny asparagové..
Některé aminotransferázové enzymy mohou kromě pyridoxal fosfátu použít pyruvát jako „koenzym“, jako je glutamát-pyruvát transamináza, která katalyzuje následující reakci:
glutamát + pyruvát ↔ alanin + α-ketoglutarát
Svalové buňky závisí na této reakci na produkci alaninu z pyruvátu a na energii prostřednictvím Krebsova cyklu prostřednictvím α-ketoglutarátu. V těchto buňkách závisí použití alaninu jako zdroje energie na eliminaci aminoskupin, jako jsou amonné ionty, v játrech prostřednictvím cyklu močoviny..
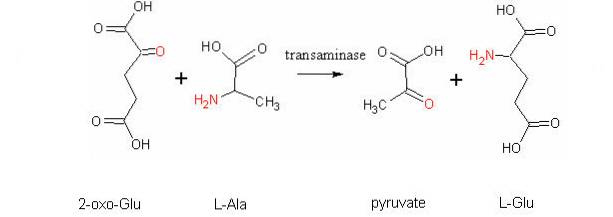
Další velmi důležitou transaminační reakcí u různých druhů je reakce katalyzovaná enzymem aspartátaminotransferázou:
L-aspartát + α-ketoglutarát ↔ oxaloacetát + L-glutamát
V neposlední řadě je to transaminační reakce kyseliny y-aminomáselné (GABA), neproteinové aminokyseliny nezbytné pro centrální nervový systém, která funguje jako inhibiční neurotransmiter. Reakce je katalyzována transaminázou kyseliny y-aminomáselné a probíhá zhruba takto:
α-ketoglutarát + kyselina 4-aminobutanová ↔ glutamát + jantarový semialdehyd
Jantarový semialdehyd se oxidační reakcí přeměňuje na kyselinu jantarovou a ta může vstoupit do Krebsova cyklu pro výrobu energie.
Reference
- Bhagavan, N.V., a Ha, C.E. (2002). Metabolismus bílkovin a aminokyselin. Medical Biochemistry (4th ed.), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S., & Cohen, P. P. (1950). Rozsah transaminační reakce ve zvířecích tkáních. Journal of Biological Chemistry, 187, 439-452.
- Ha, C. E., & Bhagavan, N. V. (2011). Základy lékařské biochemie: s klinickými případy. Akademický tisk.
- Litwack, G. (2017). Lidská biochemie. Akademický tisk.
- Rowsell, E. V. (1956). Transaminace pyruvátem a dalšími α-keto kyselinami. Biochemical Journal, 64 (2), 246.
- Snell, E. E., a Jenkins, W. T. (1959). Mechanismus transaminační reakce. Časopis buněčné a srovnávací fyziologie, 54 (S1), 161-177.



Zatím žádné komentáře