
Struktura triethylaminu, vlastnosti, použití a rizika
The triethylamin je organická sloučenina, přesněji alifatický amin, jehož chemický vzorec je N (CHdvaCH3)3 nebo NEt3. Stejně jako jiné kapalné aminy má podobný zápach jako čpavek smíchaný s rybami; díky jeho výparům je zdlouhavé a nebezpečné manipulovat s touto látkou bez digestoře nebo vhodného oblečení.
Kromě svých příslušných vzorců je tato sloučenina často zkrácena jako TEA; to však může vést k záměně s jinými aminy, jako je triethanolamin, N (EtOH)3, nebo tetraethylamonium, kvartérní amin, NEt4+.

Z jeho skeletu (horní obrázek) lze říci, že triethylamin je docela podobný amoniaku; zatímco druhá má tři vodíky, NH3, první má tři ethylové skupiny, N (CHdvaCH3)3. Jeho syntéza začíná zpracováním kapalného amoniaku s ethanolem a dochází k alkylaci.
Síť3 může tvořit hygroskopickou sůl s HCl: triethylamin hydrochlorid, NEt3· HCl. Kromě toho se podílí jako homogenní katalyzátor na syntéze esterů a amidů, což z něj činí nezbytné rozpouštědlo v organických laboratořích..
Spolu s dalšími činidly také umožňuje oxidaci primárních a sekundárních alkoholů na aldehydy a ketony. Jako amoniak je báze, a proto může tvořit organické soli neutralizačními reakcemi.
Rejstřík článků
- 1 Struktura triethylaminu
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Bod varu
- 2.4 Teplota tání
- 2.5 Hustota
- 2.6 Rozpustnost
- 2.7 Hustota par
- 2.8 Tlak par
- 2.9 Henryho konstanta
- 2.10 Bod vzplanutí
- 2.11 Teplota samovznícení
- 2.12 Tepelná kapacita
- 2.13 Spalné teplo
- 2.14 Odpařovací teplo
- 2.15 Povrchové napětí
- 2.16 Index lomu
- 2.17 Viskozita
- 2.18 Konstanta bazicity
- 2.19 Zásaditost
- 3 použití
- 3.1 Polymery
- 3.2 Chromatografie
- 3.3 Obchodní produkty
- 4 Rizika
- 5 Reference
Struktura triethylaminu
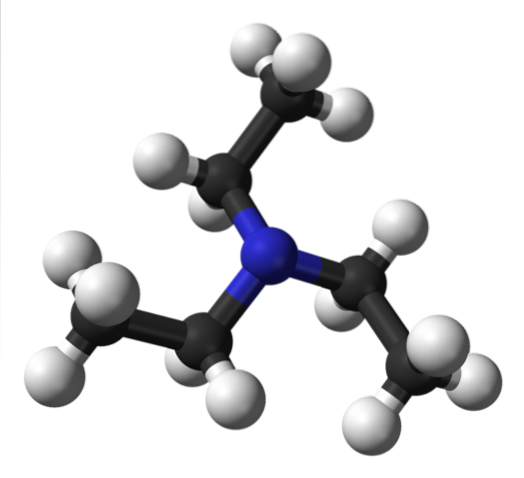
Horní obrázek ukazuje strukturu triethylaminu s modelem koulí a tyčí. Ve středu molekuly je atom dusíku, představovaný modravou koulí; a spojené s ní, tři ethylové skupiny, jako malé větve černé a bílé koule.
I když nejsou viditelné pouhým okem, na atomu dusíku je pár nesdílených elektronů. Tyto dva elektrony a tři -CH skupinydvaCH3 zažívají elektronické odpuzování; ale na druhé straně přispívají k definování dipólového momentu molekuly.
Avšak takový dipólový moment je menší než například u diethylaminu, NHEtdva; a podobně mu chybí jakákoli možnost tvorby vodíkových vazeb.
Je to proto, že v triethylaminu není vazba N-H, a v důsledku toho jsou pozorovány nižší teploty tání a teploty varu ve srovnání s jinými aminy, které interagují tímto způsobem..
I když je zde mírný dipólový moment, nelze vyloučit disperzní síly mezi ethylovými skupinami molekul NEt.3 sousedé. Sečtením tohoto efektu je oprávněné, proč, i když je triethylamin těkavý, díky své relativně velké molekulové hmotnosti vře kolem 89 ° C..
Vlastnosti
Fyzický vzhled
Bezbarvá kapalina s nepříjemným čpavkem a rybí vůní.
Molární hmotnost
101,193 g / mol.
Bod varu
89 ° C.
Bod tání
-115 ° C Všimněte si, jak slabé jsou mezimolekulární síly, které váží molekuly triethylaminu v jejich pevné látce.
Hustota
0,7255 g / ml.
Rozpustnost
Je relativně rozpustný ve vodě, 5,5 g / 100 g při 20 ° C. Podle Pubchem je to pod 18,7 ° C s tím dokonce mísitelné.
Kromě toho, že „vychází“ s vodou, je také rozpustný v acetonu, benzenu, ethanolu, etheru a parafinu..
Hustota par
3,49 v poměru vzduchu.
Tlak páry
57,07 mmHg při 25 ° C.
Henryho konstanta
66 μmol / Pa Kg.
bod vznícení
-15 ° C.
teplota samovznícení
312 ° C.
Tepelná kapacita
216,43 kJ / mol.
Spalné teplo
10 248 kcal / g.
Odpařovací teplo
34,84 kJ / mol.
Povrchové napětí
20,22 N / m při 25 ° C.
Index lomu
1400 při 20 ° C.
Viskozita
0,347 mPa · s při 25 ° C.
Konstanta bazicity
Triethylamin má pKb rovný 3,25.
Zásaditost
Zásaditost pro tento amin lze vyjádřit následující chemickou rovnicí:
Síť3 + HA <=> NHEt3+ + NA-
Kde HA je slabě kyselý druh. Pár NHEt3+NA- tvoří to, co se stane terciární amonnou solí.
Konjugovaná kyselina NHEt3+ je stabilnější než amonium, NH4+, protože tři ethylové skupiny darují část své elektronové hustoty ke snížení kladného náboje na atomu dusíku; proto je triethylamin více bazický než amoniak (ale méně zásaditý než OH-).
Aplikace

Zásaditost, v tomto případě nukleofilita triethylaminu, se používá ke katalyzování syntézy esterů a amidů ze společného substrátu: acylchloridu, RCOCl (horní obrázek).
Zde volný pár elektronů z dusíku napadá karbonylovou skupinu a tvoří meziprodukt; který je následně napaden alkoholem nebo aminem za vzniku esteru nebo amidu.
V první řadě obrazu je vizualizován mechanismus následovaný reakcí na produkci esteru, zatímco druhá řada odpovídá amidu. Všimněte si, že triethylaminhydrochlorid, NEt, se produkuje v obou reakcích3HCl, ze kterého se izoluje katalyzátor, aby se zahájil další cyklus.
Polymery
Nukleofilnost triethylaminu se také používá k přidání do určitých polymerů, jejich vytvrzení a získání větší hmotnosti. Je například součástí syntézy polykarbonátových pryskyřic, polyuretanových pěn a epoxidových pryskyřic.
Chromatografie
Jeho vzdálená amfifilita a těkavost umožňují, aby jeho odvozené soli byly použity jako činidla při iontoměničové chromatografii. Dalším implicitním použitím triethylaminu je, že z něj lze získat různé terciární aminové soli, jako je triethylamin-hydrogenuhličitan, NHEt3HCO3 (nebo TEAB).
Komerční produkty
Používá se jako přísada do složení cigaret a tabáku, konzervantů potravin, čisticích prostředků na podlahy, aromat, pesticidů, barviv atd..
Rizika
Triethylaminové výpary jsou nejen nepříjemné, ale i nebezpečné, protože mohou dráždit nos, krk a plíce, což vede k plicnímu edému nebo bronchitidě. Podobně jsou hustší a těžší než vzduch a zůstávají v jedné rovině se zemí a pohybují se k možným zdrojům tepla, které později explodují..
Nádoby s touto kapalinou by měly být co nejdále od ohně, protože představují bezprostřední nebezpečí výbuchu..
Kromě toho je třeba se vyhnout jeho kontaktu s druhy nebo činidly, jako jsou: alkalické kovy, kyselina trichloroctová, dusičnany, kyselina dusičná (protože by tvořila nitrosoaminy, karcinogenní sloučeniny), silné kyseliny, peroxidy a manganistany..
Neměl by se dotýkat hliníku, mědi, zinku nebo jejich slitin, protože je schopen je korodovat.
Pokud jde o fyzický kontakt, může dojít k alergiím a kožním vyrážkám, pokud je expozice akutní. Kromě plic může ovlivnit játra a ledviny. A pokud jde o kontakt s očima, způsobuje podráždění, které by mohlo dokonce poškodit oči, pokud nebudou ošetřeny nebo vyčištěny včas..
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Wikipedia. (2019). Triethylamin. Obnoveno z: en.wikipedia.org
- Merck. (2019). Triethylamin. Obnoveno z: sigmaaldrich.com
- Národní centrum pro biotechnologické informace. (2019). Triethylamin. Databáze PubChem. CID = 8471. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Toxikologická datová síť. (s.f.). Triethylamin. Obnoveno z: toxnet.nlm.nih.gov
- Ministerstvo zdravotnictví v New Jersey. (2010). Triethylamin. Obnoveno z: nj.gov


Zatím žádné komentáře