
Tubulin Alpha a Beta, funkce
The tubulin je globulární dimerní protein složený ze dvou polypeptidů: alfa a beta tubulinu. Jsou uspořádány ve formě tuby, aby vznikly mikrotubuly, které společně s aktinovými mikrofilamenty a mezivlákny tvoří cytoskelet.
Mikrotubuly se nacházejí v různých základních biologických strukturách, jako jsou například bičíky spermií, rozšíření řasnatých organismů, řasinky průdušnice a vejcovody..
Kromě toho struktury, které tubulin tvoří, fungují jako transportní cesty - analogické stopám vlaku - materiálů a organel v buňce. Vytěsnění látek a struktur je možné díky motorickým proteinům spojeným s mikrotubuly, které se nazývají kinesin a dynein..
Rejstřík článků
- 1 Obecná charakteristika
- 2 Alfa a beta tubulin
- 3 funkce
- 3.1 Cytoskelet
- 3.2 Mitóza
- 3.3 Centrozom
- 4 Evoluční perspektiva
- 5 Reference
Obecná charakteristika
Tubulinové podjednotky jsou 55 000 daltonových heterodimerů a jsou stavebními kameny mikrotubulů. Tubulin se nachází ve všech eukaryotických organismech a během evoluce byl vysoce konzervovaný.
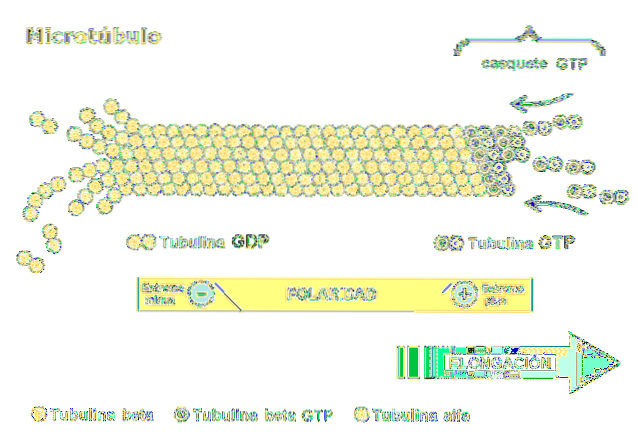
Dimer je tvořen dvěma polypeptidy zvanými alfa a beta tubulin. Ty polymerují za vzniku mikrotubulů, které se skládají ze třinácti protofilamentů uspořádaných paralelně ve tvaru duté trubice..
Jednou z nejdůležitějších charakteristik mikrotubulů je polarita struktury. Jinými slovy, dva konce mikrotubulů nejsou stejné: jeden konec se nazývá rychle rostoucí nebo „více“ konec a druhý je pomalu rostoucí nebo „méně“ konec..
Polarita je důležitá, protože určuje směr pohybu podél mikrotubulu. Dimér tubulinu je schopen polymerovat a depolarizovat v rychlých montážních cyklech. Tento jev se vyskytuje také u aktinových vláken.
Existuje třetí typ podjednotky: je to gama tubulin. Toto není část mikrotubulů a je umístěno v centrosomech; podílí se však na nukleaci a tvorbě mikrotubulů.
Alfa a beta tubulin
Alfa a beta podjednotky se silně sdružují a tvoří složitý heterodimer. Interakce komplexu je ve skutečnosti tak intenzivní, že za normálních podmínek nedojde k jeho disociaci..
Tyto proteiny jsou tvořeny 550 aminokyselinami, většinou kyselými. Ačkoli jsou alfa a beta tubuliny velmi podobné, jsou kódovány různými geny..
V alfa tubulinu lze nalézt zbytky aminokyselin s acetylovou skupinou, což jí dává různé vlastnosti v buněčných bičících..
Každá podjednotka tubulinu je spojena se dvěma molekulami: v alfa tubulinu se GTP nevratně váže a nedochází k hydrolýze sloučeniny, zatímco druhé vazebné místo v beta tubulinu reverzibilně váže GTP a hydrolyzuje jej..
Výsledkem hydrolýzy GTP je jev zvaný „dynamická nestabilita“, kde mikrotubuly procházejí cykly růstu a poklesu, v závislosti na rychlosti přidání tubulinu a rychlosti hydrolýzy GTP..
Tento jev má za následek vysokou rychlost obratu mikrotubulů, kde poločas rozpadu struktury je jen několik minut..
Funkce
Cytoskelet
Alfa a beta podjednotky tubulinu polymerují za vzniku mikrotubulů, které jsou součástí cytoskeletu.
Kromě mikrotubulů je cytoskelet tvořen dvěma dalšími strukturními prvky: aktinovými mikrofilamenty o velikosti přibližně 7 nm a mezivlákny o průměru 10 až 15 nm..
Cytoskelet je kostrou buňky, podporuje a udržuje tvar buňky. Membránové a subcelulární oddíly však nejsou statické a jsou v neustálých pohybech, aby dokázaly provádět jevy endocytózy, fagocytózy a sekrece materiálů..
Struktura cytoskeletu umožňuje buňce přizpůsobit se a plnit všechny výše uvedené funkce..
Je to ideální médium pro buněčné organely, plazmatickou membránu a další buněčné komponenty pro plnění jejich normálních funkcí, kromě účasti na dělení buněk.
Přispívají také k buněčným pohybovým jevům, jako je pohyb améby, a specializovaným strukturám pro pohyb, jako jsou řasy a bičíky. Nakonec je zodpovědný za pohyb svalů.
Mitóza
Díky dynamické nestabilitě mohou být mikrotubuly během procesů buněčného dělení zcela reorganizovány. Uspořádání mikrotubulů během rozhraní je schopné rozebrat a tubulinové podjednotky jsou volné.
Tubulin se může znovu sestavit a vést k mitotickému vřetenu, které se účastní separace chromozomů.
Existují určité léky, jako je kolchicin, taxol a vinblastin, které narušují procesy dělení buněk. Působí přímo na molekuly tubulinu a ovlivňuje jev shromažďování a disociace mikrotubulů.
Centrosome
V živočišných buňkách se mikrotubuly rozšiřují do centrosomu, struktury blízké jádru tvořené párem centriolů (každý orientovaný kolmo) a obklopený amorfní látkou, která se nazývá pericentriolární matice..
Centrioly jsou válcovitá tělesa tvořená devíti triplety mikrotubulů, v organizaci podobné řasinkám a buněčným bičíkům..
V procesu buněčného dělení vycházejí mikrotubuly z centrosomů, čímž vytvářejí mitotické vřeteno, odpovědné za správnou distribuci chromozomů do nových dceřiných buněk..
Zdá se, že centrioly nejsou nezbytné pro shromáždění mikrotubulů v buňkách, protože nejsou přítomny v rostlinných buňkách nebo v některých eukaryotických buňkách, jako jsou vajíčka určitých hlodavců.
V pericentriolární matrici dochází k iniciaci pro shromáždění mikrotubulů, kde dochází k nukleaci pomocí gama tubulinu.
Evoluční perspektiva
Tři typy tubulinu (alfa, beta a gama) jsou kódovány různými geny a jsou homologní s genem nalezeným u prokaryot, který kóduje 40 000 daltonový protein, nazývaný FtsZ. Bakteriální protein je funkčně a strukturně podobný tubulinu.
Je pravděpodobné, že protein měl funkci předků v bakteriích a byl modifikován během evolučních procesů, což vedlo k závěru, že protein má funkce, které plní u eukaryot.
Reference
- Cardinali, D. P. (2007). Aplikovaná neurověda: její základy. Panamerican Medical Ed..
- Cooper, G.M. (2000). Buňka: Molekulární přístup. 2. vydání. Sunderland (MA): Sinauer Associates.
- Curtis, H., & Schnek, A. (2006). Pozvánka na biologii. Panamerican Medical Ed..
- Frixione, E., & Meza, I. (2017). Živé stroje: Jak se buňky pohybují?. Fond hospodářské kultury.
- Lodish H, Berk A, Zipursky SL a kol. (2000). Molekulární buněčná biologie. 4. vydání. New York: W. H. Freeman.


Zatím žádné komentáře