
Struktura oxidu zinečnatého (ZnO), vlastnosti, použití, rizika

The oxid zinečnatý Je to anorganická sloučenina, jejíž chemický vzorec je ZnO. Skládá se pouze z iontů Zndva+ mědva- v poměru 1: 1; jeho krystalická mřížka však může představovat volné místo Odva-, což vede ke strukturálním vadám schopným změnit barvy vašich syntetických krystalů.
Komerčně se získává jako práškovitě bílá pevná látka (spodní obrázek), která se vyrábí přímo z oxidace kovového zinku francouzským postupem; nebo podrobení zinkových rud karbotermické redukci takovým způsobem, že jejich páry jsou poté oxidovány a nakonec ztuhnou.

Jiné způsoby přípravy ZnO spočívají ve vysrážení jeho hydroxidu, Zn (OH)dva, z vodných roztoků solí zinku. Podobně lze morfologicky rozmanité tenké filmy nebo nanočástice ZnO syntetizovat pomocí sofistikovanějších technik, jako je chemická depozice jeho par..
Tento oxid kovu se v přírodě vyskytuje jako minerál zinečnan, jehož krystaly jsou obvykle žluté nebo oranžové kvůli kovovým nečistotám. Krystaly ZnO se vyznačují tím, že jsou piezoelektrické, termochromní, luminiscenční, polární a také mají ve svých polovodičových vlastnostech velmi široké energetické pásmo.
Strukturálně je isomorfní vůči sulfidu zinečnatému, ZnS, přičemž přijímá šestihranné a kubické krystaly podobné krystalům wurzitu a směsi. V nich existuje určitý kovalentní charakter v interakcích mezi Zndva+ mědva-, což způsobuje heterogenní rozložení nábojů v krystalu ZnO.
Studie vlastností a použití ZnO sahají do oblasti fyziky, elektroniky a biomedicíny. Jeho nejjednodušší a nejběžnější použití zůstává bez povšimnutí ve složení pleťových krémů a produktů osobní hygieny i v opalovacích krémech.
Rejstřík článků
- 1 Struktura
- 1.1 Polymorfy
- 1.2 Interakce
- 1.3 Morfologie nanočástic
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Bod tání
- 2.4 Hustota
- 2.5 Rozpustnost ve vodě
- 2.6 Amfoterismus
- 2.7 Tepelná kapacita
- 2.8 Přímá energetická mezera
- 3 použití
- 3.1 Léčivé
- 3.2 Antibakteriální
- 3.3 Pigmenty a nátěry
- 3.4 Bioobrazy
- 3.5 Aditivní
- 3.6 Zachytávač sirovodíku
- 4 Rizika
- 5 Reference
Struktura
Polymorfy
ZnO krystalizuje za normálních podmínek tlaku a teploty v hexagonální struktuře wurzitu. V této struktuře ionty Zndva+ mědva- jsou uspořádány ve střídavých vrstvách tak, že každá z nich končí obklopena čtyřstěnem se ZnO4 nebo OZn4, resp.
Také pomocí „šablony“ nebo kubické podpory může být ZnO vyroben tak, aby krystalizoval do kubické struktury směsi zinku; které, stejně jako wurzit, odpovídají izomorfním strukturám (identickým v prostoru, ale s různými ionty) sulfidu zinečnatého, ZnS.
Kromě těchto dvou struktur (wurzit a blende) krystaluje ZnO pod vysokým tlakem (kolem 10 GPa) ve struktuře kamenné soli, stejné jako u NaCl.
Interakce
Interakce mezi Zndva+ mědva- představují určitý charakter kovalence, takže existuje částečně kovalentní vazba Zn-O (oba atomy se sp hybridizací3) a díky zkreslení čtyřstěnů projevují dipólový moment, který zvyšuje iontové přitažlivosti krystalů ZnO.
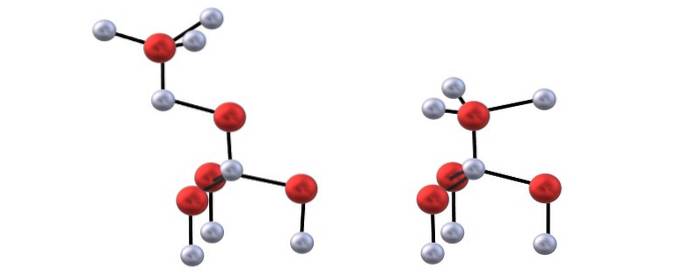
Máte horní obrázek k vizualizaci čtyřstěnů zmíněných pro struktury ZnO.
Rozdíl mezi strukturami blenda a wurzite spočívá také ve skutečnosti, že při pohledu shora nejsou ionty zatměny. Například u wurzitu se cení, že bílé koule (Zndva+) jsou těsně nad červenými koulemi (O.dva-). Na druhou stranu se to v kubické struktuře směsi nestává, protože existují tři vrstvy: A, B a C místo pouze dvou.
Morfologie nanočástic
Ačkoli krystaly ZnO mají tendenci mít hexagonální struktury wurzitu, morfologie jejich nanočástic je jiným příběhem. V závislosti na parametrech a metodách syntézy mohou mít různé formy, jako jsou například tyče, talíře, listy, koule, květiny, opasky, jehly..
Vlastnosti
Fyzický vzhled
Bílá práškovitá pevná látka bez zápachu s hořkou chutí. V přírodě se nachází krystalizovaný s kovovými nečistotami, jako je minerál zinečnatý. Jsou-li takové krystaly bílé, představují termochromismus, což znamená, že při zahřátí mění svoji barvu: z bílé na žlutou..
Podobně mohou jeho syntetické krystaly vykazovat načervenalé nebo nazelenalé barvy v závislosti na jejich stechiometrickém složení kyslíku; to znamená mezery nebo volná místa způsobená nedostatkem aniontů Odva- přímo ovlivňuje způsob, jakým světlo interaguje s iontovými sítěmi.
Molární hmotnost
81,406 g / mol
Bod tání
1974 ° C Při této teplotě prochází tepelným rozkladem za uvolňování par zinku a molekulárního nebo plynného kyslíku..
Hustota
5,1 g / cm3
Rozpustnost ve vodě
ZnO je prakticky nerozpustný ve vodě a těžko vytváří roztoky s koncentrací 0,0004% při 18 ° C.
Amfoterismus
ZnO může reagovat s kyselinami i zásadami. Když reaguje s kyselinou ve vodném roztoku, zvyšuje se jeho rozpustnost tvorbou rozpustné soli, kde Zndva+ končí komplexováním s molekulami vody: [Zn (OHdva)6]dva+. Například reaguje s kyselinou sírovou za vzniku síranu zinečnatého:
ZnO + HdvaSW4 → ZnSO4 + HdvaNEBO
Podobně reaguje s mastnými kyselinami za vzniku jejich příslušných solí, jako je stearát zinečnatý a palmitát..
A když reaguje s bází, za přítomnosti vody se tvoří soli zinku:
ZnO + 2NaOH + HdvaO → Nadva[Zn (OH)4]
Tepelná kapacita
40,3 J / K mol
Přímá energetická mezera
3,3 eV. Tato hodnota z něj činí širokopásmový polovodič schopný provozu v intenzivních elektrických polích. Má také vlastnosti polovodiče tohoto typu n, který nebyl schopen vysvětlit důvody, proč je v jeho struktuře další příspěvek elektronů.
Tento oxid se vyznačuje optickými, akustickými a elektronickými vlastnostmi, díky nimž je považován za kandidáta na potenciální aplikace související s vývojem optoelektronických zařízení (senzory, laserové diody, fotovoltaické články). Důvod pro takové vlastnosti přesahuje oblast fyziky.
Aplikace
Léčivý
Oxid zinečnatý se používá jako přísada do mnoha bílých krémů k léčbě podráždění, akné, dermatitidy, odřenin a prasklin na pokožce. V této oblasti je jeho použití oblíbené ke zmírnění podráždění způsobených plenkami na pokožce kojenců..
Je také součástí opalovacích krémů, protože společně s nanočásticemi oxidu titaničitého, TiOdva, Pomáhá blokovat sluneční ultrafialové záření a také působí jako zahušťovadlo, proto se vyskytuje v určitých lehkých make-upech, krémech, smaltech, mastcích a mýdlech..
Na druhou stranu je ZnO zdrojem zinku používaného v doplňcích stravy a vitaminových produktech, stejně jako v obilovinách..
Antibakteriální
Podle morfologie jejích nanočástic může být ZnO aktivován pod ultrafialovým zářením za vzniku peroxidů vodíku nebo reaktivních látek, které oslabují buněčné membrány mikroorganismů.
Když k tomu dojde, zbývající nanočástice ZnO rozbrázdí cytoplazmu a začnou interagovat s kompendiem biomolekul, které tvoří buňku, což vede k jejich apoptóze..
Proto nelze v přípravcích na ochranu proti slunečnímu záření použít všechny nanočástice, ale pouze ty, které postrádají antibakteriální aktivitu..
Výrobky s tímto typem ZnO jsou navrženy a potaženy rozpustnými polymerními materiály k léčbě infekcí, ran, vředů, bakterií a dokonce i cukrovky..
Pigmenty a povlaky
Pigment známý jako bílý zinek je ZnO, který se přidává do různých barev a povlaků k ochraně kovových povrchů, kde jsou nanášeny před korozí. Například povlaky s přidaným ZnO se používají k ochraně pozinkovaného železa..
Na druhou stranu se tyto povlaky používají také na okenní sklo, aby se zabránilo pronikání tepla (pokud je venku) nebo vnikání (pokud je uvnitř). Stejně tak chrání některé polymerní a textilní materiály před poškozením v důsledku působení slunečního záření a tepla..
Bioobrazy
Luminiscence nanočástic ZnO byla studována pro použití v bioimagingu, a tak studovala vnitřní struktury buněk prostřednictvím modrého, zeleného nebo oranžového světla, které vyzařuje..
Přísada
ZnO také nachází použití jako přísada do kaučuků, cementů, materiálů pro čištění zubů, sklenic a keramiky kvůli své nižší teplotě tání, a proto se chová jako tavidlo..
Eliminátor sirovodíku
ZnO odstraňuje nepříjemné H plynydvaAno, pomoc při odsíření některých výparů:
ZnO + HdvaS → ZnS + HdvaNEBO
Rizika
Oxid zinečnatý jako takový je netoxická a neškodná sloučenina, takže obezřetné zacházení s jeho pevnou látkou nepředstavuje žádné riziko..
Problém však spočívá v jeho kouři, protože i když se při vysokých teplotách rozkládá, páry zinku nakonec kontaminují plíce a způsobují jakousi „kovovou horečku“. Toto onemocnění je charakterizováno příznaky kašle, horečky, pocitu svírání na hrudi a neustálé kovové chuti v ústech..
Rovněž není karcinogenní a nebylo prokázáno, že krémy, které jej obsahují, zvyšují absorpci zinku do pokožky, proto jsou opalovací krémy na bázi ZnO považovány za bezpečné; pokud nedojde k alergickým reakcím, v takovém případě by mělo být užívání zastaveno.
Pokud jde o určité nanočástice určené k boji proti bakteriím, mohly by mít nepříznivé účinky, pokud nebudou správně transportovány na místo působení..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Oxid zinečnatý. Obnoveno z: en.wikipedia.org
- Hadis Morkoç a Ümit Özgur. (2009). Oxid zinečnatý: základy, materiály a technologie zařízení. [PDF]. Obnoveno z: application.wiley-vch.de
- Parihar, M. Raja a R. Paulose. (2018). Stručný přehled strukturních, elektrických a elektrochemických vlastností nanočástic oxidu zinečnatého. [PDF]. Obnoveno z: ipme.ru
- A. Rodnyi a I. V. Khodyuk. (2011). Optické a luminiscenční vlastnosti oxidu zinečnatého. Obnoveno z: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin, & Husen, A. (2018). Vlastnosti nanočástic oxidu zinečnatého a jejich aktivita proti mikrobům. Nanoscale research letters, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- Fakta o chemické bezpečnosti. (2019). Oxid zinečnatý. Obnoveno z: chemicalafetyfacts.org
- Jinhuan Jiang, Jiang Pi a Jiye Cai. (2018). Pokrok nanočástic oxidu zinečnatého pro biomedicínské aplikace. Bioinorganic Chemistry and Applications, sv. 2018, ID článku 1062562, 18 stran. doi.org/10.1155/2018/1062562



Zatím žádné komentáře