
Historie zinku, vlastnosti, struktura, rizika, použití
The zinek Jedná se o přechodný kov, který patří do skupiny 12 periodické tabulky a je reprezentován chemickým symbolem Zn. Jedná se o prvek číslo 24 v hojnosti v zemské kůře, který se nachází v sírových minerálech, jako je sfalerit, nebo v uhličitanech, jako je smitsonit..
V populární kultuře je to velmi známý kov; Příkladem jsou zinkové střechy, stejně jako doplňky k regulaci mužských hormonů. Nachází se v mnoha potravinách a je základním prvkem pro bezpočet metabolických procesů. Existuje několik výhod jeho mírného příjmu ve srovnání s negativními účinky jeho přebytku v těle.

Zinek je znám dlouho před pozinkováním ocelí a jiných kovů stříbrnou barvou. Mosaz, slitina různého složení mědi a zinku, je součástí historických předmětů po tisíce let. Dnes je jeho zlatá barva obvykle vidět na některých hudebních nástrojích.
Stejně tak se jedná o kov, z něhož se vyrábějí alkalické baterie, protože díky své redukční síle a snadnosti darování elektronů je dobrou volbou jako anodický materiál. Jeho hlavním použitím je pozinkování ocelí a jejich pokrytí vrstvou zinku, která oxiduje nebo se obětuje, aby se zabránilo pozdější korozi železa pod ním..
Ve svých derivátových sloučeninách má téměř vždy oxidační číslo nebo stav +2. Proto je uvažován ion Zndva+ zahalen v molekulárním nebo iontovém prostředí. Zatímco Zndva+ je to Lewisova kyselina, která může způsobit problémy v buňkách, koordinovaná s jinými molekulami, pozitivně interaguje s enzymy a DNA.
Zinek je tedy důležitým kofaktorem pro mnoho metaloenzymů. Navzdory své nesmírně důležité biochemii a lesku svých nazelenalých záblesků a plamenů při hoření je ve světě vědy považován za „nudný“ kov; protože jeho vlastnosti postrádají přitažlivost jiných kovů, stejně jako jeho teplota tání je podstatně nižší než jejich.
Rejstřík článků
- 1 Historie
- 1.1 Starověk
- 1.2 Izolace
- 2 Fyzikální a chemické vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Atomové číslo (Z)
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Teplota samovznícení
- 2.7 Hustota
- 2.8 Fúzní teplo
- 2.9 Odpařovací teplo
- 2.10 Molární tepelná kapacita
- 2.11 Elektronegativita
- 2.12 Ionizační energie
- 2.13 Atomový poloměr
- 2.14 Kovalentní poloměr
- 2.15 Mohsova tvrdost
- 2.16 Magnetické pořadí
- 2.17 Tepelná vodivost
- 2.18 Elektrický měrný odpor
- 2.19 Rozpustnost
- 2.20 Rozklad
- 2.21 Chemické reakce
- 2.22 Izotopy
- 3 Struktura a elektronická konfigurace
- 3.1 oxidační čísla
- 4 Jak to získat
- 4.1 Surovina
- 4.2 Kalcinace
- 4.3 Pyrometalurgický proces
- 4.4 Elektrolytický proces
- 5 Rizika
- 6 použití
- 6.1 - Kov
- 6.2 - Sloučeniny
- 7 Biologická role
- 7.1 V karboanhydrázě a karboxypeptidáze
- 7.2 Ve funkci prostaty
- 7.3 Zinkové prsty
- 7.4 Při regulaci glutamátu
- 8 Reference
Příběh
Starověk
Zinek byl manipulován tisíce let; ale nepozorovaně, protože starověké civilizace, včetně Peršanů, Římanů, Transylvánců a Řeků, již vyráběly mosazné předměty, mince a zbraně.
Proto je mosaz jednou z nejstarších známých slitin. Připravili ho z minerálu calamine, Zn4AnodvaNEBO7(ACH)dvaHdvaNebo které rozemleli a zahřáli v přítomnosti vlny a mědi.
Během procesu malé množství kovového zinku, které se mohlo vytvořit, uniklo jako pára, což vedlo ke zpoždění jeho identifikace jako chemického prvku na celá léta. Postupem staletí mosaz a jiné slitiny zvyšovaly svůj obsah zinku a vypadaly více šedavě.
Ve 14. století se jim v Indii již podařilo vyrobit kovový zinek, kterému říkali Jasada a v té době to uvedli na trh s Čínou.
A tak ho alchymisté mohli získat, aby mohli provádět své experimenty. Byl to renomovaný historický hrdina Paracelsus, který jej pojmenoval „zinek“, pravděpodobně podle podobnosti mezi krystaly zinku a zuby. Postupně, uprostřed jiných jmen a různých kultur, název „zinek“ skončil pro tento kov.
Izolace
Ačkoli Indie již vyráběla kovový zinek od 13. století, pocházelo to z metody, při které se používal kalamín s vlnou; nešlo tedy o kovový vzorek značné čistoty. William Champion tuto metodu vylepšil v roce 1738 ve Velké Británii pomocí vertikální retortové pece.
V roce 1746 německý chemik Andreas Sigismund Marggraf získal „poprvé“ vzorek čistého zinku zahříváním kalaminu v přítomnosti dřevěného uhlí (lepší redukční činidlo než vlna) uvnitř nádoby s mědí. Tento způsob výroby zinku se vyvinul komerčně a souběžně se způsobem Champion.
Později byly vyvinuty procesy, které se nakonec staly nezávislými na kalaminu a místo toho používaly oxid zinečnatý; jinými slovy, velmi podobný současnému pyrometalurgickému procesu. Pece se také zlepšily a byly schopny produkovat rostoucí množství zinku..
Do té doby stále neexistovala aplikace vyžadující obrovské množství zinku; ale to se změnilo s přispěním Luigiho Galvaniho a Alessandra Volty, kteří ustoupili konceptu galvanizace. Volta také přišel s takzvaným galvanickým článkem a zinek byl brzy součástí konstrukce suchých článků..
Fyzikální a chemické vlastnosti
Fyzický vzhled
Je to šedivý kov, obvykle dostupný ve formě granulí nebo prášku. Fyzicky je slabý, takže to není dobrá volba pro aplikace, kde musí podporovat těžké předměty.
Stejně tak je křehký, i když při zahřátí nad 100 ° C se stává tvárným a tvárným; až do 250 ° C, při které teplotě opět křehne a lze jej nastříkat.
Molární hmotnost
65,38 g / mol
Atomové číslo (Z)
30
Bod tání
419,53 ° C Tato nízká teplota tání svědčí o její slabé kovové vazbě. Po roztavení má podobný vzhled jako tekutý hliník.
Bod varu
907 ° C
teplota samovznícení
460 ° C
Hustota
-7,14 g / ml při teplotě místnosti
-6,57 g / ml v bodě tání, tj. Právě při tavení nebo tavení
Teplo fúze
7,32 kJ / mol
Odpařovací teplo
115 kJ / mol
Molární tepelná kapacita
25 470 J / (mol K)
Elektronegativita
1,65 na Paulingově stupnici
Ionizační energie
-První: 906,4 kJ / mol (Zn+ plynný)
-Za druhé: 1733,3 kJ / mol (Zndva+ plynný)
-Za třetí: 3833 kJ / mol (Zn3+ plynný)
Atomové rádio
Empirická 134 hod
Kovalentní poloměr
122 ± 16 hodin
Mohsova tvrdost
2.5. Tato hodnota je podstatně nižší ve srovnání s tvrdostí jiných přechodných kovů, tj. Wolframu..
Magnetický řád
Diamagnetický
Tepelná vodivost
116 W / (m K)
Elektrický odpor
59 nΩm při 20 ° C
Rozpustnost
Je nerozpustný ve vodě, pokud ho chrání jeho oxidová vrstva. Jakmile je to odstraněno působením kyseliny nebo zásady, zinek nakonec reaguje s vodou za vzniku komplexního vodného Zn (OHdva)6dva+, lokalizace Zndva+ ve středu osmistěnu ohraničeného molekulami vody.
Rozklad
Při hoření může do ovzduší uvolňovat toxické částice ZnO. V tomto procesu je pozorován nazelenalý plamen a zářící světlo.
Chemické reakce

Zinek je reaktivní kov. Při pokojové teplotě může být pokryta nejen vrstvou oxidu, ale také zásaditým uhličitanem, Zn5(ACH)6(CO.)3)dva, nebo dokonce síra, ZnS. Když je tato vrstva různého složení zničena útokem kyseliny, kov reaguje:
Zn (s) + HdvaSW4(ac) → Zndva+(ac) + SO42−(ac) + Hdva(G)
Chemická rovnice odpovídající její reakci s kyselinou sírovou a:
Zn (s) + 4 HNO3(ac) → Zn (NO3)dva(ac) + 2 NOdva(g) + 2 HdvaO (l)
S kyselinou chlorovodíkovou. V obou případech, i když to není písemné, je komplexní vodný Zn (OHdva)6dva+; kromě případů, kdy je médium zásadité, protože se vysráží jako hydroxid zinečnatý, Zn (OH)dva:
Zndva+(aq) + 2OH-(ac) → Zn (OH)dva(s)
Což je bílý, amorfní a amfoterní hydroxid, schopný pokračovat v reakci s více OH ionty-:
Zn (OH)dva(s) + 2OH-(ac) → Zn (OH)4dva-(ac)
Zn (OH)4dva- je zinočnatý anion. Ve skutečnosti, když zinek reaguje s tak silnou bází, jako je koncentrovaný NaOH, komplex zinočnatý sodný, Nadva[Zn (OH4]:
Zn (s) + 2NaOH (aq) + 2HdvaO (l) → Nadva[Zn (OH4)] (aq) + Hdva(G)
Podobně může zinek reagovat s nekovovými prvky, jako jsou halogeny v plynném stavu nebo síra:
Zn (s) + I.dva(g) → ZnIdva(s)
Zn (s) + S (s) → ZnS (s) (horní obrázek)
Izotopy
Zinek existuje v přírodě jako pět izotopů: 64Zn (49,2%), 66Zn (27,7%), 68Zn (18,5%), 67Zn (4%) a 70Zn (0,62%). Ostatní jsou syntetické a radioaktivní.
Struktura a elektronická konfigurace
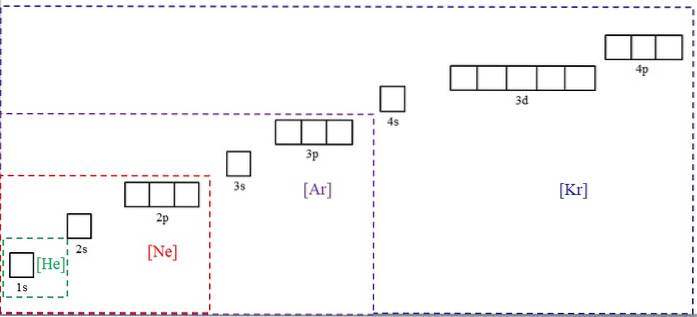
Atomy zinku krystalizují do kompaktní, ale zkreslené hexagonální struktury (hcp), která je produktem jejich kovové vazby. Valenční elektrony, které řídí tyto interakce, jsou podle elektronové konfigurace ty, které patří do orbitálů 3d a 4s:
[Ar] 3d10 4 sdva
Oba orbitaly jsou zcela naplněny elektrony, takže jejich překrytí není příliš účinné, i když na ně zinková jádra působí přitažlivou silou..
V důsledku toho nejsou atomy Zn příliš soudržné, což se odráží v jejich nízké teplotě tání (419,53 ° C) ve srovnání s jinými přechodnými kovy. Ve skutečnosti se jedná o charakteristiku kovů skupiny 12 (spolu se rtutí a kadmiem), takže si někdy kladou otázku, zda by měly být skutečně považovány za prvky bloku d.
Ačkoli jsou orbitaly 3d a 4s plné, zinek je dobrým vodičem elektřiny; proto jeho valenční elektrony mohou „skákat“ do vodivého pásma.
Oxidační čísla
Je nemožné, aby zinek ztratil svých dvanáct valenčních elektronů nebo měl oxidační číslo nebo stav +12, za předpokladu existence kationtu Zn.12+. Místo toho ztrácí pouze dva ze svých elektronů; konkrétně 4s orbitální, chující se podobně jako kovy alkalických zemin (pan Becambara).
Když k tomu dojde, říká se, že se zinek podílí na sloučenině s oxidačním číslem nebo stavem +2; to znamená za předpokladu existence kationtu Zndva+. Například ve svém oxidu ZnO má zinek toto oxidační číslo (Zndva+NEBOdva-). Totéž platí pro mnoho dalších sloučenin, které si začínají myslet, že existuje pouze Zn (II).
Existuje však také Zn (I) nebo Zn+, který ztratil pouze jeden z elektronů orbitálu 4s. Další možné oxidační číslo pro zinek je 0 (Zn0), kde jeho neutrální atomy interagují s plynnými nebo organickými molekulami. Lze jej proto prezentovat jako Zndva+, Zn+ nebo Zn0.
Jak se to získává
Surovina

Zinek je na 24. pozici nejhojnějších prvků v zemské kůře. Obvykle se nachází v sirných minerálech distribuovaných po celé planetě.
K získání kovu v čisté formě je nejprve nutné shromáždit horniny v podzemních tunelech a koncentrovat minerály bohaté na zinek, které představují skutečnou surovinu..
Mezi tyto minerály patří: sfalerit nebo wurzit (ZnS), zinek (ZnO), willemit (ZndvaAno4), smitsonit (ZnCO3) a gahnite (ZnAldvaNEBO4). Sfalerit je zdaleka hlavním zdrojem zinku.
Kalcinace
Jakmile je minerál po procesu flotace a čištění hornin koncentrován, musí být kalcinován, aby se sulfidy přeměnily na příslušné minerály. V tomto kroku se minerál jednoduše zahřívá v přítomnosti kyslíku, čímž dochází k následující chemické reakci:
2 ZnS + 3dva(g) → 2 ZnO (s) + 2 SOdva(G)
SOdva také reaguje s kyslíkem za vzniku SO3, sloučenina určená pro syntézu kyseliny sírové.
Jakmile je ZnO získán, může projít buď pyrometalurgickým procesem, nebo elektrolýzou, kde konečným výsledkem je tvorba kovového zinku..
Pyrometalurgický proces
ZnO se redukuje pomocí uhlí (minerálu nebo koksu) nebo oxidu uhelnatého:
2 ZnO (s) + C (s) → 2 Zn (g) + COdva(G)
ZnO (s) + CO (g) → Zn (g) + COdva(G)
Problémem, kterému tento proces čelí, je tvorba plynného zinku v důsledku jeho nízké teploty varu, kterou překonávají vysoké teploty pece. Proto musí být páry zinku destilovány a odděleny od ostatních plynů, zatímco jejich krystaly kondenzují na roztaveném olovu..
Elektrolytický proces
Ze dvou metod sběru je to celosvětově nejrozšířenější. ZnO reaguje se zředěnou kyselinou sírovou, aby vyluhoval ionty zinku jako svou síranovou sůl:
ZnO (s) + HdvaSW4(ac) → ZnSO4(ac) + HdvaO (l)
Nakonec je toto řešení elektrolyzováno za vzniku kovového zinku:
2 ZnSO4(ac) + 2 HdvaO (l) → 2 Zn (s) + 2 HdvaSW4(ac) + O.dva(G)
Rizika
V podkapitole o chemických reakcích bylo zmíněno, že plynný vodík je jedním z hlavních produktů, když zinek reaguje s vodou. Proto musí být v kovovém stavu řádně skladovány a mimo dosah kyselin, zásad, vody, síry nebo jakéhokoli zdroje tepla; jinak hrozí nebezpečí požáru.
Čím jemnější je zinek rozdělen, tím větší je riziko požáru nebo dokonce výbuchu..
Jinak, pokud teplota není blízká 500 ° C, její pevná nebo zrnitá forma nepředstavuje žádné nebezpečí. Pokud je pokryta vrstvou oxidu, lze s ní manipulovat holýma rukama, protože nereaguje s jejich vlhkostí; jako každá pevná látka však dráždí oči a dýchací cesty.
Přestože je zinek pro zdraví nezbytný, nadměrná dávka může způsobit následující příznaky nebo nežádoucí účinky:
- Nevolnost, zvracení, poruchy trávení, bolesti hlavy a bolesti žaludku nebo průjem.
- Vyměňuje měď a železo během absorpce ze střeva, což se projevuje zvýšením slabosti končetin.
- Ledvinové kameny.
- Ztráta čichu.
Aplikace
- Kov
Slitiny

Možná je zinek jedním z kovů spolu s mědí, které tvoří nejoblíbenější slitiny: mosaz a pozinkované železo. Mosaz byl během hudebního orchestru pozorován při mnoha příležitostech, protože zlatá záře nástrojů je částečně způsobena uvedenou slitinou mědi a zinku..
Samotný kovový zinek nemá mnoho použití, i když je srolovaný, slouží jako anoda pro suché články a v práškové formě je zamýšlen jako redukční činidlo. Když je vrstva tohoto kovu elektrolyticky nanesena na jiný, první vrstva chrání druhou před korozí tím, že je náchylnější k oxidaci; to znamená, že zinek před železem oxiduje.
Proto jsou oceli pozinkovány (potaženy zinkem), aby se zvýšila jejich životnost. Příklady těchto pozinkovaných ocelí jsou také v nekonečných „zinkových“ střechách, z nichž některé jsou opatřeny zelenou barvou, a v karoseriích autobusů, domácích potřebách a visutých mostech..
K dispozici je také aluzinc, slitina hliníku a zinku používaná v civilních stavbách..
Redukční prostředek
Zinek je dobré redukční činidlo, takže ztrácí své elektrony, aby získal jiný druh; zejména kovový kation. Pokud je ve formě prášku, je jeho redukční účinek ještě rychlejší než u pevných granulí..
Používá se v procesech získávání kovů z jejich minerálů; jako je rhodium, stříbro, kadmium, zlato a měď.
Podobně se jeho redukční účinek používá k redukci organických látek, které mohou být zahrnuty v ropném průmyslu, jako je benzen a benzín, nebo ve farmaceutickém průmyslu. Na druhou stranu, zinkový prach nachází uplatnění i v alkalických bateriích zinku a manganičitanu..
Smíšený
Zinkový prach, vzhledem ke své reaktivitě a energetičtějšímu spalování, nachází použití jako přísada v zápalkových hlavách, ve výbušninách a ohňostrojích (dodávají bílé záblesky a nazelenalé plameny)..
- Sloučeniny
Sulfid

Sulfid zinečnatý má tu vlastnost, že je fosforeskující a luminiscenční, a proto se používá při výrobě světelných barev..
Kysličník
Bílá barva jeho oxidu, stejně jako jeho poloviční a foto vodivost, se používá jako pigment v keramice a papírech. Kromě toho je přítomen v mastku, kosmetice, gumách, plastech, látkách, léčivech, inkoustech a smaltech..
Doplněk výživy
Naše tělo potřebuje zinek, aby plnilo mnoho svých životně důležitých funkcí. Pro jeho získání je začleněn do některých doplňků výživy ve formě oxidu, glukonátu nebo acetátu. Je také přítomen v krémech ke zmírnění popálenin a podráždění pokožky a v šamponech.
Některé výhody známé nebo spojené s užíváním zinku jsou:
- Zlepšuje imunitní systém.
- Je to dobrý protizánětlivý prostředek.
- Snižuje nepříjemné příznaky nachlazení.
- Zabraňuje poškození buněk v sítnici, proto se doporučuje pro vidění.
- Pomáhá regulovat hladinu testosteronu a je také spojena s plodností mužů, kvalitou jejich spermií a vývojem svalové tkáně..
- Reguluje interakce mezi neurony mozku, a proto je spojena se zlepšením paměti a učení.
-A navíc je účinný při léčbě průjmu.
Tyto doplňky zinku jsou komerčně dostupné jako kapsle, tablety nebo sirupy..
Biologická role
V karboanhydrázě a karboxypeptidáze
Předpokládá se, že zinek je součástí 10% celkových enzymů v lidském těle, přibližně 300 enzymů. Mezi nimi lze uvést karboanhydrázu a karboxypeptidázu..
Karboanhydráza, enzym závislý na zinku, působí na tkáňové úrovni katalyzováním reakce oxidu uhličitého s vodou za vzniku hydrogenuhličitanu. Když se hydrogenuhličitan dostane do plic, enzym obrátí reakci a vytvoří se oxid uhličitý, který je během výdechu vyloučen ven.
Karboxypeptidáza je exopeptidáza, která štěpí proteiny a uvolňuje aminokyseliny. Zinek funguje tak, že dodává pozitivní náboj, který usnadňuje interakci enzymu s bílkovinou, kterou tráví..
Ve funkci prostaty
Zinek je přítomen v různých orgánech lidského těla, ale má nejvyšší koncentraci v prostatě a ve spermatu. Zinek je zodpovědný za správné fungování prostaty a vývoj mužských reprodukčních orgánů.
Zinkové prsty
Zinek se podílí na metabolismu RNA a DNA. Zinkové prsty (Zn-prsty) se skládají z atomů zinku, které slouží jako můstky mezi proteiny, které se společně účastní různých funkcí.
Zinkové prsty jsou užitečné při čtení, psaní a transkripci DNA. Kromě toho existují hormony, které je používají při funkcích spojených s růstovou homeostázou v celém těle..
Při regulaci glutamátu
Glutamát je hlavním excitačním neurotransmiterem v mozkové kůře a mozkovém kmeni. Zinek se hromadí v glutaminergních presynaptických vezikulích a zasahuje do regulace uvolňování glutamátu neurotransmiteru a do neuronální excitability.
Existují důkazy, že přehnané uvolňování glutamátu neurotransmiteru může mít neurotoxický účinek. Proto existují mechanismy, které regulují jeho uvolňování. Homeostáza zinku tedy hraje důležitou roli ve funkční regulaci nervového systému..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Zinek. Obnoveno z: en.wikipedia.org
- Michael Pilgaard. (2016, 16. července). Zinek: chemické reakce. Obnoveno z: pilgaardelements.com
- Národní centrum pro biotechnologické informace. (2019). Zinek. Databáze PubChem. CID = 23994. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wojes Ryan. (25. června 2019). Vlastnosti a použití zinkového kovu. Obnoveno z: thebalance.com
- Pan Kevin A. Boudreaux. (s.f.). Zinek + síra. Obnoveno z: angelo.edu
- Alan W. Richards. (12. dubna 2019). Zpracování zinku. Encyklopedie Britannica. Obnoveno z: britannica.com
- Čisté zinkové kovy. (2015). Průmyslové aplikace. Obnoveno z: purityzinc.com
- Nordqvist, J. (5. prosince 2017). Jaké jsou zdravotní výhody zinku? Lékařské zprávy dnes. Obnoveno z: medicalnewstoday.com


Zatím žádné komentáře