
Historie rubidia, vlastnosti, struktura, získávání, použití
The rubidium Jedná se o kovový prvek, který patří do skupiny 1 periodické tabulky: prvek alkalických kovů, který je reprezentován chemickým symbolem Rb. Jeho název zní podobně jako rubín, a to proto, že když byl objeven, jeho emisní spektrum vykazovalo charakteristické linie tmavě červené barvy..
Je to jeden z nejreaktivnějších kovů, které existují. Je to první z alkalických kovů, který, i když není příliš hustý, klesá do vody. Reaguje s ním také výbušněji ve srovnání s lithiem, sodíkem a draslíkem. Byly provedeny experimenty, při kterých praskly puchýře tam, kde jsou uloženy (spodní obrázek), aby spadly a vybuchly ve vaně.

Rubidium se vyznačuje tím, že je dražším kovem než samotné zlato; ne tolik kvůli jeho nedostatku, ale kvůli jeho široké mineralogické distribuci v zemské kůře a obtížím, které vznikají při jeho izolaci ze sloučenin draslíku a cesia..
Ukazuje jasnou tendenci spojovat se s draslíkem v jeho minerálech, které se nacházejí jako nečistoty. Nejen v geochemických záležitostech tvoří duo s draslíkem, ale také v oblasti biochemie.
Organismus „zaměňuje“ ionty K.+ těmi z Rb+; rubidium však dosud není podstatným prvkem, protože jeho role v metabolismu není známa. Přesto se doplňky rubidia používají ke zmírnění určitých zdravotních stavů, jako je deprese a epilepsie. Na druhou stranu oba ionty vydávají fialový plamen žáru zapalovače.
Vzhledem k jeho vysokým nákladům nejsou jeho aplikace příliš založeny na syntéze katalyzátorů nebo materiálů, ale jako součást různých zařízení s teoretickými fyzikálními základy. Jedním z nich jsou atomové hodiny, solární články a magnetometry. To je důvod, proč je rubidium někdy považováno za podceňovaný nebo nedostatečně studovaný kov..
Rejstřík článků
- 1 Historie
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Atomové číslo (Z)
- 2.3 Molární hmotnost
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Fúzní teplo
- 2.8 Odpařovací teplo
- 2.9 Elektronegativita
- 2.10 Elektronická afinita
- 2.11 Ionizační energie
- 2.12 Atomový poloměr
- 2.13 Tepelná vodivost
- 2.14 Elektrický odpor
- 2.15 Mohsova tvrdost
- 2.16 Reaktivita
- 3 Struktura a elektronická konfigurace
- 3.1 oxidační čísla
- 3.2 Klastry
- 4 Kde najít a získat
- 4.1 Zemská kůra
- 4.2 Geochemická asociace
- 4.3 Frakční krystalizace
- 4.4 Elektrolýza nebo redukce
- 5 izotopů
- 6 Rizika
- 6.1 Kov
- 6,2 iontů
- 7 použití
- 7.1 Sběrač plynu
- 7.2 Pyrotechnika
- 7.3 Dodatek
- 7.4 Bose-Einsteinův kondenzát
- 7.5 Diagnóza nádorů
- 7.6 Součást
- 7.7 Atomové hodiny
- 8 Reference
Příběh
Rubidium objevili v roce 1861 němečtí chemici Robert Bunsen a Gustav Kirchhoff pomocí spektroskopie. K tomu použili Bunsenův hořák a spektroskop, které byly vynalezeny o dva roky dříve, a také analytické techniky srážení. Jeho předmětem studia byl minerál lepidolit, jehož vzorek byl odebrán ze Saska v Německu.
Vycházeli ze 150 kg minerálu lepidolitu, který ošetřili kyselinou chloroplatinovou HdvaPtCl6, k vysrážení hexachloroplatinátu draselného, K.dvaPtCl6. Když však studovali jeho spektrum spalováním v Bunsenově hořáku, uvědomili si, že vykazuje emisní čáry, které se v té době neshodovaly s žádným jiným prvkem..
Emisní spektrum tohoto nového prvku se vyznačuje tím, že má dvě dobře definované čáry v červené oblasti. Proto jej pokřtili jménem „rubidus“, což znamená „tmavě červená“. Později se Bunsenovi a Kirchhoffovi podařilo Rb oddělitdvaPtCl6 od K.dvaPtCl6 frakční krystalizací; konečně ji pomocí vodíku snížit na svou chloridovou sůl.
Když němečtí chemici identifikovali a izolovali sůl nového prvku rubidia, stačilo ji zredukovat na kovový stav. Aby toho dosáhli, zkusili to dvěma způsoby: elektrolýzou na chlorid rubidný nebo zahřátím soli, která se snáze redukuje, jako je její vínan. Bylo to tak, že se zrodilo kovové rubidium.
Fyzikální a chemické vlastnosti
Vzhled
Měkký, stříbrošedý kov. Je tak hladký, že vypadá jako máslo. Obvykle je balen ve skleněných ampulích, ve kterých převládá inertní atmosféra, která jej chrání před reakcí se vzduchem..
Atomové číslo (Z)
37
Molární hmotnost
85,4678 g / mol
Bod tání
39 ° C
Bod varu
688 ° C
Hustota
Při pokojové teplotě: 1,532 g / cm3
Při teplotě tání: 1,46 g / cm3
Hustota rubidia je vyšší než hustota vody, takže klesne, zatímco s ním bude prudce reagovat.
Teplo fúze
2,19 kJ / mol
Odpařovací teplo
69 kJ / mol
Elektronegativita
0,82 na Paulingově stupnici
Elektronická afinita
46,9 kJ / mol
Ionizační energie
-První: 403 kJ / mol (Rb+ plynný)
-Za druhé: 2632,1 kJ / mol (Rbdva+ plynný)
-Za třetí: 3859,4 kJ / mol (Rb3+ plynný)
Atomové rádio
248 hodin (empirické)
Tepelná vodivost
58,2 W / (mK)
Elektrický odpor
128 nΩm při 20 ° C
Mohsova tvrdost
0,3. Proto je dokonce mastek tvrdší než kovové rubidium..
Reaktivita

Rubidium je po cesiu a francii jedním z nejreaktivnějších alkalických kovů. Jakmile je vystaven vzduchu, začne hořet, a pokud je zasažen, vystřelí lehké jiskry. Při zahřátí také vydává fialový plamen (horní obrázek), což je pozitivní test na Rb ionty.+.
Reaguje s kyslíkem za vzniku směsi peroxidů (RbdvaNEBOdva) a superoxidy (RbOdva). I když nereaguje s kyselinami a zásadami, reaguje prudce s vodou za vzniku hydroxidu rubidia a plynného vodíku:
Rb (s) + HdvaO (l) => RbOH (aq) + Hdva(G)
Reaguje s vodíkem za vzniku odpovídajícího hydridu:
Rb (s) + Hdva(g) => 2RbH (s)
A také s halogeny a sírou výbušně:
2Rb (s) + Cldva(g) => RbCl (s)
2Rb (s) + S (l) => RbdvaH.H)
Ačkoli se rubidium nepovažuje za toxický prvek, je potenciálně nebezpečné a při kontaktu s vodou a kyslíkem představuje nebezpečí požáru..
Struktura a elektronická konfigurace
Atomy rubidia jsou uspořádány takovým způsobem, že vytvářejí krystal s kubickou strukturou vycentrovanou na tělo (bcc, pro jeho zkratku v angličtině kubický střed). Tato struktura je charakteristická pro alkalické kovy, které jsou lehké a mají sklon plavat na vodě; kromě rubidia dolů (cesium a francium).
V krystalech rubidia bcc jejich atomy Rb vzájemně interagují díky kovové vazbě. Toto je řízeno „mořem elektronů“ z jeho valenčního pláště, z orbitálu 5 s podle jeho elektronické konfigurace:
[Kr] 5 s1
Všechny 5s orbitaly se svým jediným elektronem se překrývají ve všech rozměrech kovových krystalů rubidia. Tyto interakce jsou však slabé, protože při sestupu skrz skupinu alkalických kovů se orbitaly stávají difúznějšími, a proto kovová vazba oslabuje..
Proto je teplota tání rubidia 39 ° C. Stejně tak jeho slabá kovová vazba vysvětluje měkkost jeho pevné látky; tak měkký, že to vypadá jako stříbrné máslo.
Není dostatek bibliografických informací o chování jeho krystalů pod vysokým tlakem; pokud existují hustší fáze s jedinečnými vlastnostmi, jako je sodík.
Oxidační čísla
Jeho elektronická konfigurace okamžitě naznačuje, že rubidium silně inklinuje ke ztrátě svého jediného elektronu, aby se stalo izoelektronickým vůči kryptonu vzácného plynu. Když se to stane, vytvoří se monovalentní kation Rb+. Poté se říká, že ve svých sloučeninách má oxidační číslo +1, když se předpokládá existence tohoto kationtu.
Vzhledem k tendenci oxidovat rubidium je předpoklad, že Rb ionty existují+ v jeho sloučeninách je správný, což zase naznačuje iontový charakter těchto sloučenin.
Téměř ve všech sloučeninách rubidia vykazuje oxidační číslo +1. Příkladem jsou tyto:
-Chlorid rubidný, RbCl (Rb+Cl-)
-Hydroxid rubidný, RbOH (Rb+ Ach-)
-Uhličitan rubidnatý, RbdvaCO3 (Rbdva+CO3dva-)
-Oxid rubidnatý, RbdvaO (Rbdva+NEBOdva-)
-Superoxid rubidnatý, RbOdva (Rb+NEBOdva-)
I když je velmi vzácné, mohlo by rubidium mít také negativní oxidační číslo: -1 (Rb-). V tomto případě bychom mluvili o „rubididu“, pokud by tvořil sloučeninu s prvkem méně elektronegativním než on, nebo kdyby byl vystaven zvláštním a přísným podmínkám.
Klastry
Existují sloučeniny, kde jednotlivě každý atom Rb představuje oxidační čísla se zlomkovými hodnotami. Například v Rb6O (Rb6dva+NEBOdva-) a Rb9NEBOdva (Rb94+NEBOdvadva-) kladný náboj je rozdělen mezi sadu atomů Rb (klastrů). Tedy v Rb6Nebo by oxidační číslo teoreticky bylo +1/3; zatímco v Rb9NEBOdva, + 0,444 (4/9).
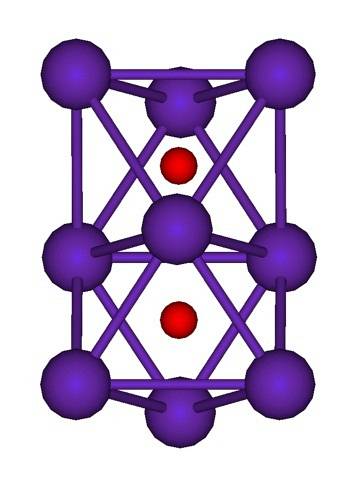
Klastrová struktura Rb je uvedena výše.9NEBOdva představovaný modelem koulí a tyčí. Všimněte si, jak devět atomů Rb „obklopuje“ O anionty.dva-.
Pro objasnění je to, jako by část původních kovových krystalů rubidia zůstala nezměněna, zatímco byly odděleny od mateřského krystalu. Ztrácejí elektrony v procesu; ty, které jsou nezbytné k přilákání Odva-, a výsledný kladný náboj je distribuován mezi všechny atomy uvedeného klastru (soubor nebo agregáty atomů Rb).
V těchto shlucích rubidia tedy nelze formálně předpokládat existenci Rb.+. Rb6O a Rb9NEBOdva Jsou klasifikovány jako suboxidy rubidia, ve kterých je splněna tato zjevná anomálie přebytku atomů kovů ve vztahu k oxidovým aniontům.
Kde najít a získat
zemská kůra

Rubidium je 23. nejhojnějším prvkem v zemské kůře a jeho množství je srovnatelné s množstvím kovů zinku, olova, cesia a mědi. Podrobnosti spočívají v tom, že jeho ionty jsou široce rozptýlené, takže nepřevládá v žádném minerálu jako hlavní kovový prvek a jeho rudy jsou také vzácné..
Z tohoto důvodu je rubidium velmi drahý kov, dokonce více než samotné zlato, protože jeho proces získávání z rud je složitý kvůli obtížnosti jeho využití..
V přírodě se rubidium vzhledem ke své reaktivitě nenachází v původním stavu, ale jako oxid (RbdvaO), chlorid (RbCl) nebo spolu s dalšími anionty. Jeho „volné“ ionty Rb+ se nacházejí v mořích s koncentrací 125 µg / l, stejně jako v horkých pramenech a řekách.
Mezi minerály zemské kůry, které ji obsahují v koncentraci nižší než 1%, máme:
-Leucite, K [AlSidvaNEBO6]
-Polucita, Cs (SidvaAhoj6NHdvaNEBO
-Carnalite, KMgCl36HdvaNEBO
-Zinnwaldite, KLiFeAl (AlSi3)NEBO10(OH, F)dva
-Amazonite, Pb, KAlSi3NEBO8
-Petalite, LiAlSi4NEBO10
-Biotit, K (Mg, Fe)3AlSi3NEBO10(OH, F)dva
-Rubicline, (Rb, K) AlSi3NEBO8
-Lepidolit, K (Li, Al)3(Ano, Al)4NEBO10(F, OH)dva
Geochemická asociace
Všechny tyto minerály mají jednu nebo dvě společné věci: jsou to křemičitany draselné, cesné nebo lithné, nebo jsou to minerální soli těchto kovů..
To znamená, že rubidium má silnou tendenci se sdružovat s draslíkem a cesiem; Může dokonce nahradit draslík během krystalizace minerálů nebo hornin, jak se to děje na ložiskách pegmatitů, když krystalizuje magma. Rubidium je tedy vedlejším produktem těžby a rafinace těchto hornin a jejich minerálů..
Rubidium lze také nalézt v běžných horninách, jako je žula, jíly a čedič, a dokonce i v ložiskách karbonu. Ze všech přírodních zdrojů představuje lepidolit svou hlavní rudu, ze které se komerčně těží..
Naproti tomu v karnalitu lze rubidium nalézt jako nečistoty RbCl s obsahem 0,035%. A ve vyšší koncentraci jsou ložiska polucitu a rubiclinu, která mohou mít až 17% rubidia..
Jeho geochemická asociace s draslíkem je způsobena podobností jejich iontových poloměrů; Rb+ je větší než K.+, ale rozdíl ve velikostech není překážkou pro to, aby první mohl nahradit druhou ve svých minerálních krystalech.
Frakční krystalizace
Ať už začínáme s lepidolitem nebo polucitem, nebo s některým z minerálů uvedených výše, výzva zůstává ve větší či menší míře stejná: oddělit rubidium od draslíku a cesia; to znamená použít techniky separace směsí, které umožňují mít sloučeniny nebo soli rubidia na jedné straně a draslíku a cesia na straně druhé..
To je obtížné, protože tyto ionty (K.+, Rb+ a Čs+) mají velkou chemickou podobnost; Reagují stejným způsobem za vzniku stejných solí, které se díky své hustotě a rozpustnosti stěží navzájem liší. Proto se používá frakční krystalizace, aby mohly krystalizovat pomalu a kontrolovaně..
Například se tato technika používá k oddělení směsi uhličitanů a kamence z těchto kovů. Procesy rekrystalizace musí být několikrát opakovány, aby se zajistily krystaly vyšší čistoty a bez spolu vysrážených iontů; rubidiová sůl, která krystalizuje s ionty K.+ nebo Čs+ na jeho povrchu nebo uvnitř.
Modernější techniky, jako je použití iontoměničové pryskyřice nebo korunové ethery jako komplexotvorné látky, také umožňují izolaci Rb iontů.+.
Elektrolýza nebo redukce
Jakmile byla rubidiová sůl oddělena a vyčištěna, dalším a posledním krokem je redukce Rb kationtů+ na pevný kov. Za tímto účelem se sůl roztaví a podrobí elektrolýze, takže se na katodě vysráží rubidium; nebo se používá silné redukční činidlo, jako je vápník a sodík, schopné rychle ztrácet elektrony a tím redukovat rubidium.
Izotopy
Rubidium se na Zemi vyskytuje jako dva přírodní izotopy: 85Rb a 87Rb. První má hojnost 72,17%, zatímco druhý 27,83%.
The 87Rb je zodpovědný za to, že tento kov je radioaktivní; jeho záření je však neškodné a pro analýzu datování dokonce prospěšné. Jeho poločas rozpadu (t1/2) je 4 91010 let, jejichž časové rozpětí přesahuje věk vesmíru. Když se rozpadne, stane se stabilním izotopem 87pan.
Díky tomu byl tento izotop používán k datu věku suchozemských minerálů a hornin přítomných od počátku Země..
Kromě izotopů 85Rb a 87Rb, existují i jiné syntetické a radioaktivní s proměnnou a mnohem kratší životností; Například jemu 82Rb (t1/2= 76 sekund), 83Rb (t1/2= 86,2 dnů), 84Rb (t1/2= 32,9 dnů) a 86Rb (t1/2= 18,7 dnů). Ze všech z nich 82Rb je nejpoužívanější v lékařských studiích.
Rizika
Kov
Rubidium je tak reaktivní kov, že musí být skladován ve skleněných ampulích pod inertní atmosférou, aby nereagoval s kyslíkem ve vzduchu. Pokud se blistr rozbije, může být kov vložen do petroleje nebo minerálního oleje, aby byl chráněn; nakonec však bude oxidován kyslíkem v nich rozpuštěným, což povede k peroxidům rubidia.
Pokud se naopak rozhodne umístit jej například na dřevo, skončí hoření fialovým plamenem. Pokud je zde velká vlhkost, bude hořet jen vystavením vzduchu. Když je velká část rubidia vržena do objemu vody, prudce exploduje, dokonce zapálí produkovaný plynný vodík.
Rubidium je proto kov, s nímž by neměl manipulovat každý, protože prakticky všechny jeho reakce jsou výbušné..
Ion
Na rozdíl od kovového rubidia, jeho Rb ionty+ nepředstavují žádné zjevné riziko pro živé bytosti. Tyto rozpuštěné ve vodě interagují s buňkami stejným způsobem jako ionty K.+.
Proto mají rubidium a draslík podobné biochemické chování; rubidium však není základním prvkem, zatímco draslík ano. Tímto způsobem znatelné množství Rb+ se mohou hromadit uvnitř buněk, červených krvinek a vnitřností, aniž by negativně ovlivňovaly tělo jakéhokoli zvířete.
Ve skutečnosti se odhadovalo, že dospělý muž s hmotností 80 kg obsahuje asi 37 mg rubidia; a že navíc zvýšení této koncentrace řádově 50 až 100krát nevede k nežádoucím příznakům.
Přebytek Rb iontů+ může skončit přemístěním iontů K.+; a následně bude jedinec trpět velmi silnými svalovými křečemi až do smrti.
Je zřejmé, že rozpustné soli nebo sloučeniny rubidia to mohou vyvolat okamžitě, takže žádná z nich by neměla být přijímána. Kromě toho může jednoduchým kontaktem způsobit popáleniny a mezi nejtoxičtější patří fluorid (RbF), hydroxid (RbOH) a kyanid (RbCN) rubidia..
Aplikace
Sběrač plynu
Rubidium se používá k zachycení nebo odstranění stop plynů, které mohou být ve vakuově uzavřených zkumavkách. Právě kvůli jejich vysoké tendenci k zachycování kyslíku a vlhkosti v nich je vylučují na svém povrchu jako peroxidy.
Pyrotechnika
Při hoření rubidiových solí vydávají charakteristický červenofialový plamen. Některé ohňostroje mají ve svém složení tyto soli, takže explodují s těmito barvami.
Doplněk
Rubidiumchlorid byl předepsán k boji proti depresi, protože studie zjistily nedostatek tohoto prvku u jedinců trpících tímto zdravotním stavem. Používá se také jako sedativum a k léčbě epilepsie.
Bose-Einsteinův kondenzát
Izotopové atomy 87Rb byly použity k vytvoření prvního Bose-Einsteinova kondenzátu. Tento stav hmoty spočívá v tom, že atomy při teplotě velmi blízké absolutní nule (0 K) jsou seskupeny nebo „kondenzovány“ a chovají se, jako by byly jedno..
Rubidium tedy bylo protagonistou tohoto triumfu v oblasti fyziky a byl to Eric Cornell, Carl Wieman a Wolfgang Ketterle, kteří díky této práci obdrželi Nobelovu cenu v roce 2001..
Diagnostika nádoru
Syntetický radioizotop 82Rb se rozpadá emitováním pozitronů, které se používají k akumulaci v tkáních bohatých na draslík; jako jsou ty, které se nacházejí v mozku nebo srdci. Používá se tedy k analýze funkčnosti srdce a přítomnosti možných nádorů v mozku pomocí pozitronové emisní tomografie..
Součástka
Rubidiové ionty si našly místo v různých druzích materiálů nebo směsí. Například jeho slitiny byly vyrobeny ze zlata, cesia, rtuti, sodíku a draslíku. Byl přidán do sklenic a keramiky pravděpodobně ke zvýšení jejich bodu tání.
V solárních článcích byly jako důležitá součást přidány perovskity. Rovněž bylo studováno jeho možné použití jako termoelektrického generátoru, materiálu pro přenos tepla v prostoru, paliva v iontových pohonných motorech, elektrolytického média pro alkalické baterie a v atomových magnetometrech..
Atomové hodiny
S rubidiem a cesiem byly vyrobeny slavné vysoce přesné atomové hodiny, které se používají například v satelitech GPS, s nimiž mohou vlastníci jejich smartphonů znát jejich polohu při pohybu na silnici.
Reference
- Bond Tom. (29. října 2008). Rubidium. Obnoveno z: chemistryworld.com
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Rubidium. Databáze PubChem. CID = 5357696. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Chellan, P. a Sadler, P. J. (2015). Prvky života a léky. Filozofické transakce. Řada A, Matematické, fyzikální a technické vědy, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Mayo Foundation for Medical Education and Research. (2019). Rubidium Rb 82 (intravenózní cesta). Obnoveno z: mayoclinic.org
- Marques Miguel. (s.f.). Rubidium. Obnoveno z: nautilus.fis.uc.pt
- James L. Dye. (12. dubna 2019). Rubidium. Encyklopedie Britannica. Obnoveno z: britannica.com
- Dr. Doug Stewart. (2019). Fakta o prvku Rubidium. Chemicool. Obnoveno z: chemicool.com
- Michael Pilgaard. (10. května 2017). Rubidiové chemické reakce. Obnoveno z: pilgaardelements.com



Zatím žádné komentáře