
50 příkladů kyselin a zásad

Jsou jich stovky příklady kyselin a zásad které lze nalézt ve všech oborech chemie, ale které jsou jako celek rozděleny do dvou velkých rodin: anorganické a organické. Anorganické kyseliny jsou obvykle známé jako minerální kyseliny, které se vyznačují tím, že jsou zvláště silné ve srovnání s organickými kyselinami..
Kyselinami a zásadami se rozumí látky, které mají kyselé nebo saponátové příchutě. Oba jsou korozivní, i když slovo 'žíravé' se často používá pro silné zásady. Sečteno a podtrženo: popáleniny a poleptání kůže při dotyku. Jeho charakteristiky při rozpouštění médií vedly celou řadu definic v celé historii..
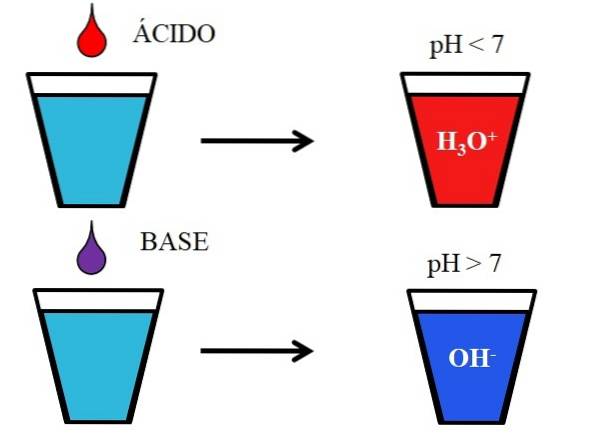
Obrázek níže ukazuje obecné chování kyselin a zásad, když jsou přidány nebo rozpuštěny ve sklenici vody. Kyseliny produkují roztoky s hodnotami pH pod 7 díky iontům hydronia, H3NEBO+; zatímco báze produkují roztoky s pH nad 7 díky hydroxylovým (nebo hydroxylovým) iontům, OH-.
Pokud do sklenice přidáme kyselinu chlorovodíkovou, HCl (červená kapka), budou tam H ionty3NEBO+ a Cl- hydratovaný. Na druhou stranu, pokud zopakujeme experiment s hydroxidem sodným, NaOH (fialová kapka), budeme mít OH ionty- a Na+.
Rejstřík článků
- 1 Definice
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1,3 Lewis
- 2 Příklady kyselin
- 3 Příklady bází
- 4 Odkazy
Definice

Stále více studované a pochopené vlastnosti kyselin a zásad zavedly více než jednu definici těchto chemických sloučenin. Mezi tyto definice patří Arrheniova, Bronsted-Lowryova a nakonec Lewisova. Než uvedeme příklady, je třeba si v tom ujasnit.
Arrhenius
Kyseliny a zásady jsou podle Arrhenia ty, které po rozpuštění ve vodě produkují ionty H.3NEBO+ nebo OH-, resp. To znamená, že obrázek již představuje tuto definici. Samo o sobě však zanedbává některé kyseliny nebo zásady příliš slabé na to, aby takové ionty produkovaly. Tady přichází definice Bronsted-Lowry..
Bronsted-Lowry
Bronsted-Lowryho kyseliny jsou ty, které mohou darovat H ionty+, a základy jsou ty, které přijímají tyto H+. Pokud kyselina velmi snadno daruje svůj H+, znamená, že je to silná kyselina. Totéž se děje se základnami, ale s přijetím H+.
Máme tedy silné nebo slabé kyseliny a zásady a jejich síly se měří v různých rozpouštědlech; zejména ve vodě, ze které jsou vytvořeny známé jednotky pH (od 0 do 14).
Proto silná kyselina HA plně daruje váš H+ na vodu v reakci typu:
HA + HdvaO => A- + H3NEBO+
Kam- je konjugovaná báze HA. Proto přichází H3NEBO+ přítomný ve skle s kyselým roztokem.
Slabá báze B mezitím zbaví vodu vody, aby získala příslušné H+:
B + HdvaNEBO <=> HB + OH-
Kde HB je konjugovaná kyselina B. To je případ amoniaku, NH3:
NH3 + HdvaNEBO <=> NH4+ + Ach-
Velmi silná báze může přímo darovat OH ionty- bez nutnosti reagovat s vodou; stejně jako NaOH.
Lewis
A konečně, Lewisovy kyseliny jsou ty, které získávají nebo přijímají elektrony, a Lewisovy báze jsou ty, které elektrony darují nebo ztrácejí..
Například základna Bronsted-Lowry NH3 Je to také Lewisova báze, protože atom dusíku přijímá H+ darováním jeho dvojice volných elektronů (H3N: H+). Proto tyto tři definice navzájem nesouhlasí, spíše se prolínají a pomáhají studovat kyselost a zásaditost v širším spektru chemických sloučenin..
Příklady kyselin
Po objasnění definic bude níže uvedena řada kyselin s příslušnými vzorci a názvy:
-HF: kyselina fluorovodíková
-HBr: kyselina bromovodíková
-HI: kyselina jodovodíková
-HdvaS: sirovodík
-HdvaSe: kyselina selenhydric
-HdvaČaj: kyselina tellurová
Jedná se o binární kyseliny, nazývané také hydracidy, ke kterým patří výše uvedená kyselina chlorovodíková HCl.
-HNO3: kyselina dusičná
-HNOdva: kyselina dusitá
-HNO: kyselina hyponitrous
-HdvaCO3: kyselina uhličitá
-HdvaCOdva: kyselina uhličitá, která je ve skutečnosti známější pod názvem kyselina mravenčí, HCOOH, nejjednodušší organická kyselina ze všech
-H3PO4: kyselina fosforečná
-H3PO3 nebo Hdva[HPO3]: kyselina fosforitá, s vazbou H-P
-H3POdva nebo H [HdvaPOdva]: kyselina fosforná, se dvěma vazbami H-P
-HdvaSW4: kyselina sírová
-HdvaSW3: kyselina sírová
-HdvaSdvaNEBO7: kyselina disulfurová
-HIO4: kyselina jodistá
-HIO3: kyselina jodičná
-HIOdva: kyselina jodová
-HIO: kyselina hypojodová
-HdvaCrO4: kyselina chromová
-HMnO4: kyselina manganová
-CH3COOH: kyselina octová (ocet)
-CH3SW3H: kyselina methansulfonová
Všechny tyto kyseliny, kromě mravenčí a posledních dvou, jsou známé jako oxokyseliny nebo ternární kyseliny..
Ostatní:
-AlCl3: chlorid hlinitý
-FeCl3: chlorid železitý
-BF3: fluorid boritý
-Kovové kationty rozpuštěné ve vodě
-Carbocations
-H (CHBjedenáctCljedenáct): superkyselý karboran
- FSO3H: kyselina fluorsulfonová
- HSbF6: kyselina fluoroantimonová
- FSO3H SbF5: magická kyselina
Poslední čtyři příklady tvoří hrůzostrašné super kyseliny; sloučeniny schopné rozložit téměř jakýkoli materiál pouhým dotykem. AlCl3 je příkladem Lewisovy kyseliny, protože kovové centrum hliníku je schopné přijímat elektrony kvůli svému elektronickému deficitu (nedokončí svůj valenční oktet).
Příklady bází
Mezi anorganickými bázemi máme hydroxidy kovů, jako je hydroxid sodný, a některé molekulární hydridy, jako je již zmíněný amoniak. Zde jsou další příklady základen:
-KOH: hydroxid draselný
-LiOH: hydroxid lithný
-RbOH: hydroxid rubidia
-CsOH: hydroxid cesný
-FrOH: hydroxid vápenatý
-Být (OH)dva: hydroxid berylnatý
-Mg (OH)dva: hydroxid hořečnatý
-Ca (OH)dva: hydroxid vápenatý
-Sr (OH)dva: hydroxid strontnatý
-Ba (OH)dva: hydroxid barnatý
-Ra (OH)dva: hydroxid radia
-Fe (OH)dva: hydroxid železnatý
-Fe (OH)3: hydroxid železitý
-Al (OH)3: hydroxid hlinitý
-Pb (OH)4: hydroxid olovnatý
-Zn (OH)dva: hydroxid zinečnatý
-Cd (OH)dva: hydroxid kademnatý
-Cu (OH)dva: hydroxid měďnatý
-Ti (OH)4: hydroxid titaničitý
-PH3: fosfin
-Popel3: arsine
-NaNHdva: amid sodný
- C5H5N: pyridin
-(CH3) N: trimethylamin
- C6H5NHdva: fenylamin nebo anilin
-NaH: hydrid sodný
-KH: hydrid draselný
-Karbanony
-Li3N: nitrid lithný
-Alkoxidy
-[(CH3)dvaCH]dvaNLi: lithiumdiisopropylamid
-Diethynylbenzenový anion: C.6H4C4dva- (dosud nejsilnější základna)
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Naomi Hennah. (10. října 2018). Jak učit kyseliny, zásady a soli. Obnoveno z: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31. srpna 2019). Vzorce běžných kyselin a zásad. Obnoveno z: thoughtco.com
- David Wood. (2019). Porovnání běžných kyselin a zásad. Studie. Obnoveno z: study.com
- Ross Pomeroy. (23. srpna 2013). Nejsilnější kyseliny na světě: jako oheň a led. Obnoveno z: realclearscience.com
- Wikipedia. (2019). Diethynylbenzen dianion. Obnoveno z: en.wikipedia.org



Zatím žádné komentáře