
Struktura oxidu cínu (II), vlastnosti, názvosloví, použití

The oxid cínatý je krystalická anorganická pevná látka, která vzniká oxidací cínu (Sn) kyslíkem, přičemž cín získá 2+ valenci. Jeho chemický vzorec je SnO. Jsou známy dvě různé formy této sloučeniny: černá a červená. Běžnou a nejstabilnější formou při pokojové teplotě je černá nebo modročerná modifikace..
Tato forma se připravuje hydrolýzou chloridu cínatého (SnCldva) ve vodném roztoku, ke kterému se přidá hydroxid amonný (NH4OH) k získání hydratované oxidové sraženiny Sn (II), jejíž vzorec je SnO.xHdvaNebo, kde x<1 (x menor que 1).
Hydratovaný oxid je bílá amorfní pevná látka, která se poté několik hodin zahřívá v suspenzi na 60-70 ° C v přítomnosti NH4OH, dokud se nezíská čistý černý krystalický SnO.
Červená forma SnO je metastabilní. Může být připraven přidáním kyseliny fosforečné (H3PO4) - s 22% kyselinou fosforitou, H3PO3 - a pak NH4OH k roztoku SnCldva. Získaná bílá pevná látka se zahřívá ve stejném roztoku na 90-100 ° C po dobu asi 10 minut. Tímto způsobem se získá čistý červený krystalický SnO.
Oxid cínatý je výchozí surovinou pro výrobu dalších sloučenin cínu (II). Z tohoto důvodu je to jedna ze sloučenin cínu, která má značný komerční význam..
Oxid cínatý má nízkou toxicitu, jak se vyskytuje u většiny anorganických sloučenin cínu. Důvodem je jeho špatná absorpce a rychlé vylučování z tkání živých bytostí..
Má jednu z nejvyšších tolerancí sloučenin cínu v testech na potkanech. Při velkém vdechování však může být škodlivý..
Rejstřík článků
- 1 Struktura
- 1.1 Modročerný oxid cínatý
- 1.2 Červený oxid cínatý
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Další vlastnosti
- 4 použití
- 4.1 Při výrobě jiných sloučenin cínu (II)
- 4.2 Ve špercích
- 4.3 Jiná použití
- 4.4 Nedávné inovace
- 5 Reference
Struktura
Modro-černý oxid cínatý
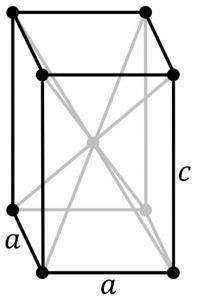
Tato modifikace krystalizuje s tetragonální strukturou. Má uspořádání vrstev, ve kterých je každý atom Sn v horní části čtvercové pyramidy, jejíž základ tvoří 4 nejbližší atomy kyslíku.
Jiní vědci tvrdí, že každý atom Sn je obklopen 5 atomy kyslíku, které jsou umístěny zhruba na vrcholech osmistěnu, kde je šestý vrchol pravděpodobně obsazen dvojicí volných nebo nepárových elektronů. Toto je známé jako Φ-oktaedrické uspořádání.
Červený oxid cínatý
Tato forma oxidu cínatého krystalizuje s ortorombickou strukturou.
Nomenklatura
- Oxid cínatý
- Oxid cínatý
- Oxid cínatý
- Oxid cínatý
Vlastnosti
Fyzický stav
Krystalická pevná látka.
Molekulární váha
134,71 g / mol.
Bod tání
1080 ° C. Rozkládá se.
Hustota
6,45 g / cm3
Rozpustnost
Nerozpustný v horké nebo studené vodě. Nerozpustný v methanolu, ale rychle se rozpouští v koncentrovaných kyselinách a zásadách.
Další vlastnosti
Při zahřátí na více než 300 ° C za přítomnosti vzduchu oxid cínu (II) rychle oxiduje na oxid cínu (IV), což vede k žhavení.
Bylo popsáno, že za neoxidačních podmínek má ohřev oxidu cínatého různé výsledky v závislosti na stupni čistoty výchozího oxidu. Obecně nepřiměřené do kovového Sn a oxidu cínatého, SnOdva, s různými přechodnými druhy, které se nakonec stanou SnOdva.
Oxid cínatý je amfoterní, protože se rozpouští v kyselinách za vzniku iontů Sndva+ nebo aniontové komplexy a také se rozpouští v alkáliích za vzniku roztoků hydroxy-tinnatových iontů, Sn (OH)3-, které mají pyramidovou strukturu.
Kromě toho je SnO redukčním činidlem a rychle reaguje s organickými a minerálními kyselinami..
Ve srovnání s jinými solemi cínu má nízkou toxicitu. Jeho LD50 (50% smrtelná dávka nebo střední smrtelná dávka) u potkanů je více než 10 000 mg / kg. To znamená, že je zapotřebí více než 10 gramů na kilogram, aby se v daném testovacím období zabilo 50% vzorků krys. Pro srovnání, fluorid cínatý má u potkanů LD50 188 mg / kg..
Pokud je však dlouhodobě inhalován, ukládá se v plicích, protože není absorbován a může způsobit stanózu (infiltrace prachu SnO do plicních mezer).
Aplikace
Při výrobě dalších sloučenin cínu (II)
Jeho rychlá reakce s kyselinami je základem jeho nejdůležitějšího použití, které je jako meziprodukt při výrobě jiných sloučenin cínu..
Používá se při výrobě bromidu cínatého (SnBrdva), kyanid cínatý (Sn (CN)dva) a hydrát fluoroboritanu cínatého (Sn (BF4)dva), mimo jiné sloučeniny cínu (II).
Fluoroboritan cínatý se připravuje rozpuštěním SnO v kyselině fluoroborité a používá se pro povlaky cínu a cínu a olova, zejména při nanášení slitin cínu a olova pro pájení v elektronickém průmyslu. To je mimo jiné způsobeno jeho vysokou kapacitou pokrytí.
Oxid cínatý se také používá při přípravě síranu cínatého (SnSO4), reakcí SnO a kyseliny sírové, HdvaSW4.
SnSO4 získaný se používá v cínovacím procesu k výrobě desek plošných spojů, k dokončování elektrických kontaktů a k pocínování kuchyňského náčiní.

Hydratovaná forma SnO, hydratovaný oxid cínatý SnO.xHdvaNebo se nechá reagovat s kyselinou fluorovodíkovou, čímž se získá fluorid cínatý, SnFdva, který se přidává do zubních past jako prostředek k boji proti dutinám.
V klenotnictví
Oxid cínatý se používá při přípravě rubínových krystalů zlato-cín a měď-cín. Jeho funkcí v této aplikaci je zřejmě působit jako redukční činidlo.

Jiná použití
Používá se ve fotovoltaických zařízeních k výrobě elektřiny ze světla, jako jsou solární články.

Nedávné inovace
Uspořádané nanočástice SnO byly použity v uhlíkových nanotrubičkových elektrodách pro lithium-sírové baterie.

Elektrody připravené na SnO vykazují vysokou vodivost a malou změnu objemu v cyklech opakovaného nabíjení a vybíjení.
SnO navíc usnadňuje rychlý přenos iontů / elektronů během oxidačně-redukčních reakcí, ke kterým v takových bateriích dochází..
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Bailar, J. C.; Emeléus, HJ; Sir Ronald Nyholm a Trotman-Dickenson, A.F. (1973). Komplexní anorganická chemie. Svazek 2. Pergamon Press.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. Svazek A27. VCH Verlagsgesellschaft mbH.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Svazek 24. Čtvrté vydání. John Wiley & Sons.
- Ostrakhovitch, Elena A. a Cherian, M. George. (2007). Cín. In Handbook of the Toxicology of Metals. Třetí edice. Obnoveno ze sciencedirect.com.
- Kwestroo, W. a Vromans, P.H.G.M. (1967). Příprava tří modifikací čistého oxidu cínatého. J. Inorg. Nucl. Chem., 1967, sv. 29, str. 2187-2190.
- Fouad, S. S. a kol. (1992). Optické vlastnosti tenkých vrstev oxidu cínatého. Československý časopis fyziky. Únor 1992, svazek 42, vydání 2. Obnoveno z springer.com.
- A-Young Kim a kol. (2017). Objednal nanočástice SnO v MWCNT jako funkční hostitelský materiál pro vysokorychlostní lithium-sírovou bateriovou katodu. Nano Research 2017, 10 (6). Obnoveno z springer.com.
- Národní lékařská knihovna. (2019). Oxid cínatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov

Zatím žádné komentáře