
Struktura octanu amonného, vlastnosti, použití a rizika
The octan amonný je anorganická sůl, jejíž chemický vzorec je NH4CH3COOH. Je odvozen ze směsi kyseliny octové přítomné v obchodním octě v koncentraci 5% a amoniaku. Obě výchozí látky mají charakteristický zápach, takže je možné získat představu, proč tato sůl voní po octě-amoniaku.
Nejvýznamnějším aspektem této soli však není její vůně, ale nízká teplota tání. Je tak nízká, že v každé laboratoři ji lze získat v kapalné verzi, kde ionty volně proudí a přenášejí elektrické náboje..

Na druhé straně je octan amonný rozvolňující; to znamená, že absorbuje vodu nebo vlhkost z prostředí, dokud se úplně nerozpustí. Proto, i když jsou jeho krystaly v bezvodém stavu bílé, rychle zářily (jako ty v kádince na obrázku výše).
Jelikož je tuhým zdrojem amoniaku, mělo by se s ním zacházet tak, aby se minimalizovalo vdechování jeho par. Ale navzdory této negativní charakteristice NH4CH3COOH je užitečný pro přípravu pufrovacích roztoků, které konzervují potraviny, jakož i jako součást určitých rozpouštědel extrahujících bílkoviny.
Rejstřík článků
- 1 Struktura octanu amonného
- 1.1 Další složení a voda
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Hustota
- 2.4 Teplota tání
- 2.5 Rozpustnost
- 2.6 Stabilita
- 2,7 pKa
- 2.8 Entalpie standardní formace
- 3 použití
- 3.1 Analytické
- 3.2 Střední vodič
- 3.3 Vyrovnávací paměť
- 3.4 Na ledu a půdě
- 3.5 Srážedlo
- 3.6 Lék
- 4 Rizika
- 5 Reference
Struktura octanu amonného
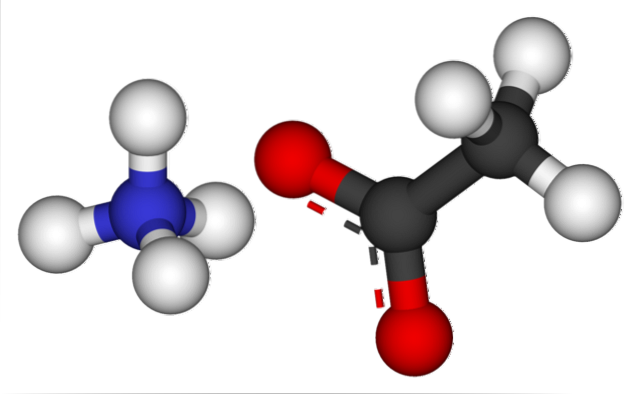
Obrázek výše ukazuje ionty, které tvoří octan amonný v modelu koulí a tyčí. Vlevo je kation čtyřstěnné geometrie, NH4+, zatímco na pravé straně je molekulární aniont se dvěma elektrony přemístěnými mezi dva atomy kyslíku, CH3VRKAT- (tečkovaná čára mezi červenými koulemi).
Takže oba ionty, NH4+ a CH3VRKAT-, drží je pohromadě jejich elektrostatická přitažlivost, která spolu s odpuzováním mezi stejnými náboji nakonec definuje krystal. Tento krystal octanu amonného má ortorombickou strukturu, kterou lze pozorovat v mikroskopických vzorcích nebo dokonce ve viditelných velikostech..
Pro tuto sůl jsou důležité nejen iontové vazby, ale také vodíkové vazby. NH4+ můžete darovat až čtyři z těchto mostů; to znamená, že v každém z vrcholů jeho čtyřstěnu je atom kyslíku z CH3VRKAT- soused (H3N+-H- OCOCH3).
Teoreticky by pak síly uvnitř vašich krystalů měly být velmi silné; ale experimentálně nastává opak, protože taje pouze při 114 ° C. Vodíkové vazby proto nekompenzují slabou iontovou vazbu ani nízkou energii mřížky ortorombického krystalu NH.4CH3VRKAT.
Další složení a voda
Původně se říkalo, že octan amonný se připravuje smícháním kyseliny octové a amoniaku. Proto může být sůl také vyjádřena jako: NH3CH3COOH. V závislosti na složení lze tedy získat další struktury: NH32CH3COOH nebo NH35CH3COOH, například.
Bylo také zmíněno, že absorbuje dost vlhkosti. Přitom začleňuje molekuly vody do svých krystalů, které hydrolyzují za vzniku NH3 nebo CH3COOH; a proto sůl vydává vůni čpavku nebo octa.
Vlastnosti
Fyzický vzhled
Průhledné bílé krystaly s vůní octa a amoniaku.
Molární hmotnost
77,083 g / mol.
Hustota
1 073 g / ml při 25 ° C.
Bod tání
114 ° C Tato hodnota je podstatně nižší ve srovnání s jinými solemi nebo iontovými sloučeninami. Kromě toho postrádá bod varu v důsledku tvorby amoniaku, což znamená rozklad soli..
Rozpustnost
143 g / 100 ml při 20 ° C Všimněte si jeho mimořádné rozpustnosti ve vodě, která ukazuje afinitu pociťovanou molekulami vody k NH iontům.4+ a CH3VRKAT-, hydratovat je ve vodných sférách.
Jeho rozpustnost není v méně polárních rozpouštědlech taková. Například ve 100 ml methanolu při 15 ° C se rozpustí 7,89 g NH4CH3VRKAT.
Stabilita
Je delikatesní, proto byste se měli vyvarovat skladování ve vlhkých prostorách. Při absorpci vody také uvolňuje amoniak, a proto se rozkládá.
pKa
9.9.
Tato konstanta odpovídá kyselosti amonného iontu:
NH4+ + B <=> NH3 + HB
Kde HB je slabá kyselina. Pokud je báze B o vodě, bude mít svoji hydrolýzní reakci:
NH4+ + HdvaNEBO <=> NH3 + H3NEBO+
Ve kterém druh H3NEBO+ definuje pH roztoku.
Na druhou stranu, acetát také přispívá k pH:
CH3VRKAT- + HdvaNEBO <=> CH3COOH + OH-
Oba druhy tedy H3NEBO+ a OH- jsou neutralizovány a dávají neutrální pH 7. Avšak podle Pubchem mají vysoce koncentrované roztoky octanu amonného kyselé pH; což znamená, že převládá hydrolýza NH4+ na CH3VRKAT-.
Entalpie standardní formace
ΔFH298 = -615 kJ / mol.
Aplikace
Analytický
Vodné roztoky octanu sodného umožňují solubilizaci síranů olovnatého, železného a zinečnatého, aby se později stanovila jejich koncentrace atomovou absorpční spektroskopií.
Střední vodič
Vzhledem k tomu, že taje při nízké teplotě ve srovnání s jinými solemi, může být jeho kapalina použita k vedení elektrického proudu, který osvětluje obvod žárovky..
Buffer
Může regulovat změny pH v kyselém nebo zásaditém rozmezí, které se používá k udržení stálého pH například v mase, čokoládě, sýrech, zelenině nebo jiných potravinářských výrobcích.
Na ledu a půdě
Jedná se o relativně levnou a biologicky odbouratelnou sůl, která se používá k odmrazování zledovatělých silnic. Podobně, protože je zdrojem dusíku rozpustného ve vodě, používá se pro zemědělské účely ke stanovení hladiny draslíku..
Srážecí činidlo
Tato sůl se používá k vysrážení proteinů pro chromatografickou analýzu..
Lék
Octan amonný pracuje jako diuretikum ve veterinární medicíně a je také nezbytnou solí pro syntézu inzulínu a penicilinu.
Rizika
Níže a nakonec jsou uvedena některá rizika nebo negativní důsledky způsobené octanem amonným:
- Může způsobit mírné podráždění pokožky, ale nevstřebává se do ní.
- Při požití způsobuje žaludeční nevolnost, průjem, diurézu, úzkost, zvýšenou potřebu močení, třes a další příznaky spojené s otravou amoniakem, stejně jako poškození jater.
- Vdechování dráždí nos, hrdlo a plíce.
U ostatních není známo, zda může způsobit rakovinu, a je vyloučeno jakékoli možné riziko požáru z této soli (alespoň za normálních podmínek skladování)..
Reference
- Inger Nahringbauer. (1967). Studie vodíkových vazeb. XIV. Krystalová struktura octanu amonného. Institute of Chemistry, University of Uppsala, Uppsala, Sweden. Acta Cryst. 23, 956.
- Národní centrum pro biotechnologické informace. (2019). Octan amonný. Databáze PubChem. CID = 517165. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Sullivan Randy. (2012). Vodivost octanu amonného. Obnoveno z: chemdemos.uoregon.edu
- Viachem, Ltd. (s.f.). Octan amonný. Obnoveno z: viacheminc.com
- Wikipedia. (2019). Octan amonný. Obnoveno z: en.wikipedia.org
- Ministerstvo zdravotnictví v New Jersey. (2012). Acetát amonný - informační list o nebezpečných látkách. [PDF]. Obnoveno z: nj.gov
- Xueyanghu. (s.f.). Použití a rizika octanu amonného. Obnoveno z: xueyanghu.wordpress.com


Zatím žádné komentáře