
Allotropy Allotropická transformace a hlavní prvky

The alotropy v chemii je charakteristikou určitých chemických prvků přítomnost v několika různých formách, ale ve stejném stavu agregace hmoty. Struktura prvků se může lišit v závislosti na jejich molekulárním uspořádání a podmínkách, ve kterých se tvoří, jako je tlak a teplota..
Pouze pokud jde o chemické prvky, používá se slovo alotropie, které označuje každý ze způsobů, jak lze prvek nalézt ve stejné fázi jako alotrop; vzhledem k tomu, že to neplatí pro sloučeniny vykazující různé krystalické struktury; v tomto případě se tomu říká polymorfismus.
Jsou známy i jiné případy, jako například u kyslíku, kdy může dojít k alotropii jako ke změně počtu atomů látky. V tomto smyslu existuje pojem dvou alotropů tohoto prvku, které jsou lépe známé jako kyslík (Odva) a ozon (O.3).
Rejstřík článků
- 1 Allotropická transformace
- 2 Hlavní alotropní prvky
- 2.1 Uhlík
- 2.2 Síra
- 2.3 Fosfor
- 2.4 Kyslík
- 3 Odkazy
Allotropická transformace
Jak již bylo zmíněno dříve, alotropy jsou různé způsoby, jak lze najít stejný prvek, takže tato změna ve struktuře způsobuje, že se tyto druhy objevují s různými fyzikálními a chemickými vlastnostmi..
Podobně k alotropické transformaci mezi jedním prvkem a druhým dochází způsobem, jakým jsou atomy uspořádány v molekulách; tj. způsob, jakým odkaz pochází.
Tato změna mezi jedním alotropem a druhým může nastat z různých důvodů, jako jsou změny podmínek tlaku, teploty a dokonce i dopad elektromagnetického záření, jako je světlo..
Pokud se změní struktura chemické látky, může také změnit její chování a upravit vlastnosti, jako je elektrická vodivost, tvrdost (v případě pevných látek), bod tání nebo varu a dokonce i fyzikální vlastnosti, jako je jeho barva..
Alotropie může být navíc dvou typů:
- Monotropní, kdy jedna ze struktur prvků má za všech podmínek větší stabilitu než ostatní.
- Enanthropic, když jsou různé struktury stabilní za různých podmínek, ale mohou se při určitých tlacích a teplotách reverzibilně transformovat do druhé.
Hlavní alotropické prvky
I když v periodické tabulce existuje více než sto známých prvků, ne všechny mají alotropické tvary. Níže jsou uvedeny nejznámější alotropy.
Uhlík
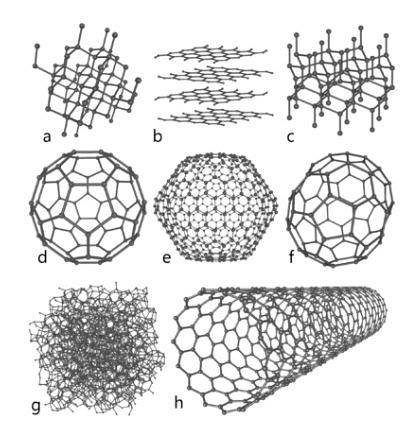
Tento prvek v přírodě s velkým množstvím představuje základní základ organické chemie. Je známo několik alotropních druhů, mezi nimiž vyniká diamant, grafit a další, které budou níže vystaveny..
diamant
Diamant ukazuje molekulární uspořádání ve formě čtyřboká krystalů, jejichž atomy jsou spojeny jednoduchými vazbami; to znamená, že jsou uspořádány hybridizací sp3.
Grafit
Grafit je tvořen po sobě jdoucími vrstvami uhlíku, kde jsou jeho atomy spojeny v hexagonálních strukturách dvojnými vazbami; tj. s hybridizací spdva.
Carbino
Kromě dvou výše zmíněných důležitých alotropů, které jsou nejznámější z uhlíku, existují další, jako je karbyn (známý je také lineární acetylenový uhlík, LAC), kde jsou jeho atomy uspořádány lineárně prostřednictvím trojných vazeb; tj. s hybridizací sp.
Ostatní
- Graphene, jehož struktura je velmi podobná grafitu).
- Fulleren nebo buckminsterfullerene, také známý jako buckyball, jehož struktura je šestihranná, ale její atomy jsou uspořádány ve tvaru prstence.
- Uhlíkové nanotrubice, válcového tvaru.
- Amorfní uhlík, bez krystalické struktury.
Síra
Síra má také několik alotropů považovaných za běžné, například následující (je třeba poznamenat, že všechny jsou v pevném stavu):
Kosočtverečná síra
Jak název napovídá, jeho krystalická struktura je tvořena osmihrannými kosočtverci a je také známá jako α síra..
Monoklinická síra
Známý jako β síra, má tvar hranolu složeného z osmi atomů síry.
Roztavená síra
Produkuje prizmatické krystaly, které jsou stabilní při určitých teplotách, a tvoří jehly zbarvené..
Síra z plastu
Také se jí říká síra, má amorfní strukturu.
Kapalná síra
Má vlastnosti viskozity na rozdíl od většiny prvků, protože v tomto allotrope roste s rostoucí teplotou.
Zápas
Tento nekovový prvek se běžně vyskytuje v přírodě v kombinaci s jinými prvky a má několik souvisejících alotropních látek:
Bílý fosfor
Je to pevná látka se čtyřbokou krystalickou strukturou a má uplatnění ve vojenské oblasti, dokonce se používá jako chemická zbraň..
Černý fosfor
Má nejvyšší stabilitu mezi alotropy tohoto prvku a je velmi podobný grafenu.
Červený fosfor
Vytváří amorfní pevnou látku s redukčními vlastnostmi, ale není toxický.
Difosfor
Jak název napovídá, je složen ze dvou atomů fosforu a je plynnou formou tohoto prvku.
Fialový fosfor
Je to pevná látka s krystalickou strukturou s monoklinickým molekulárním uspořádáním..
Šarlatový fosfor
Také pevná amorfní struktura.
Kyslík
Přestože je jedním z nejběžnějších prvků v zemské atmosféře a jedním z nejhojnějších prvků ve vesmíru, má jen málo známých alotropů, mezi nimiž vyniká dioxygen a trioxygen..
Dioxygen
Dioxygen je známější pod jednoduchým názvem kyslík, plynná látka nezbytná pro biologické procesy na této planetě..
Trioxygen
Trioxygen je lépe známý jednoduše jako ozon, vysoce reaktivní allotrope, jehož nejznámější funkcí je ochrana zemské atmosféry před vnějšími zdroji záření..
Tetraoxygen
Tvoří pevnou fázi trigonální struktury s charakteristikami metastability.
Ostatní
Existuje také šest dalších pevných látek, které tvoří kyslík, s různými krystalickými strukturami..
Stejným způsobem existují prvky, jako je selen, bór, křemík, mimo jiné, které představují různé alotropy a které byly studovány s menší nebo větší mírou hloubky..
Reference
- Wikipedia. (s.f.). Allotropy. Obnoveno z en.wikipedia.org
- Chang, R. (2007). Chemistry, deváté vydání. Mexiko: McGraw-Hill.
- Britannica, E. (s.f.). Allotropy. Obnoveno z britannica.com
- ThoughtCo. (s.f.). Definice allotrope a příklady. Obnoveno z thoughtco.com
- Ciach, R. (1998). Pokročilé lehké slitiny a kompozity. Získané z books.google.co.ve



Zatím žádné komentáře